Оксид серы(VI)
| Оксид серы(VI) | |
| Общие | |
|---|---|
| Систематическое наименование |
Оксид серы (VI)
|
| Хим. формула | SO3 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 80,06 г/моль |
| Плотность | 1,92 г/см³ |
| Термические свойства | |
| Т. плав. | 16,83 °C |
| Т. кип. | 44,9 °C |
| Энтальпия образования | -395,8 кДж/моль |
| Классификация | |
| Рег. номер CAS | [7446-11-9] |
| Безопасность | |
| ЛД50 | 510 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 Окси́д се́ры (VI) (се́рный ангидри́д, трёхо́кись се́ры, се́рный га́з) SO3 — высший оксид серы. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Окси́д се́ры (VI) (се́рный ангидри́д, трёхо́кись се́ры, се́рный га́з) SO3 — высший оксид серы. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt, NaVO3 или оксид железа(III) Fe2O3):
Можно получить термическим разложением сульфатов:
- <math>\mathsf{Fe_2(SO_4)_3 \xrightarrow[]{^ot} Fe_2O_3 + 3SO_3}</math>
или взаимодействием SO2 с озоном:
- <math>\mathsf{SO_2 + O_3 \rightarrow SO_3 + O_2}</math>
Для окисления SO2 используют также NO2:
- <math>\mathsf{SO_2 + NO_2 \rightarrow SO_3 + NO}</math>
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Физические свойства
Оксид серы(VI) — в обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
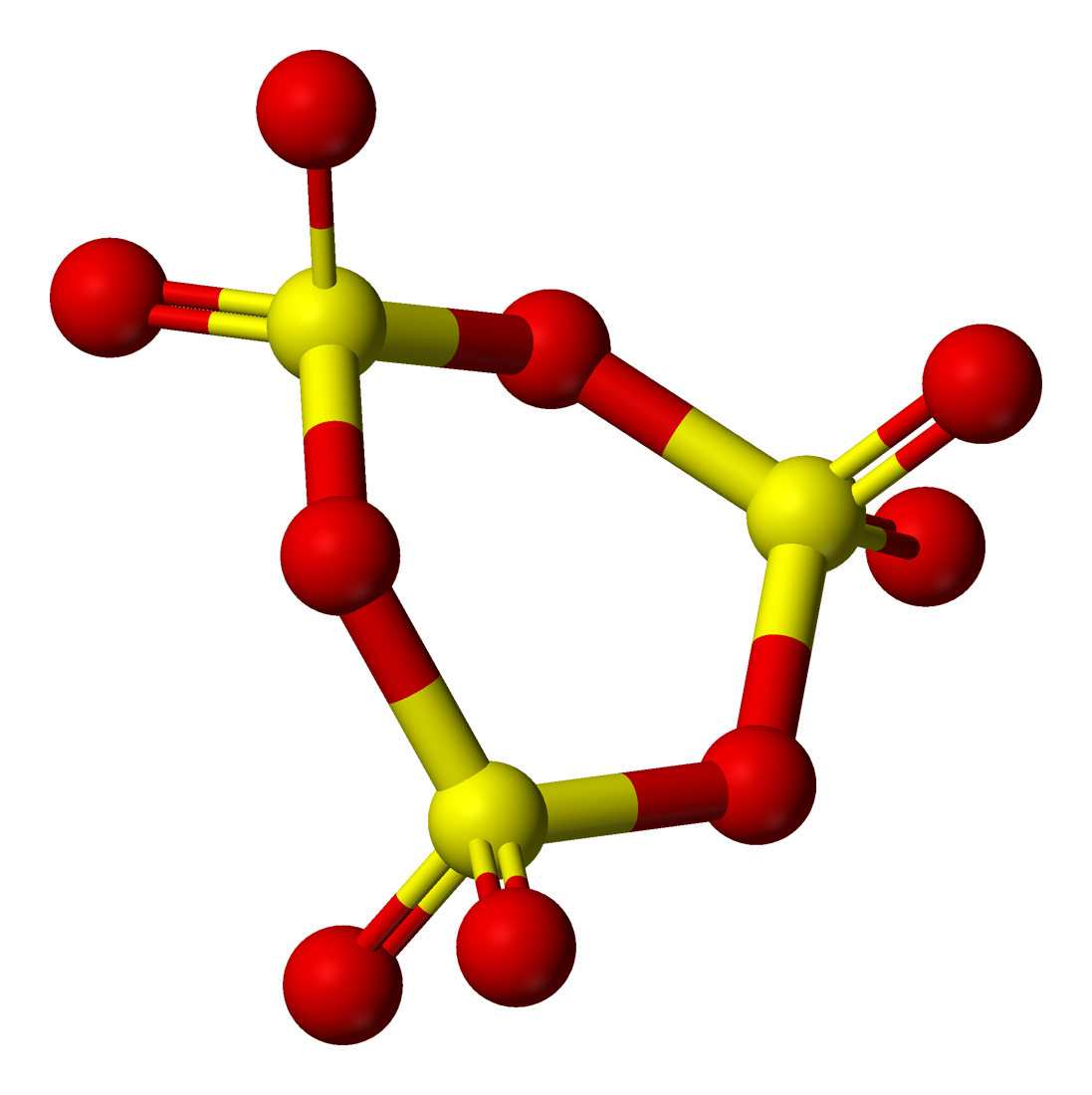
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм). При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи. Тип химической связи в молекуле: ковалентная полярная химическая связь.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Химические свойства
SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
- <math>\mathsf{SO_3 + H_2O \rightarrow H_2SO_4}</math>
Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
- <math>\mathsf{2KOH + SO_3 \rightarrow K_2SO_4 + H_2O}</math>
и оксидами:
- <math>\mathsf{CaO + SO_3 \rightarrow CaSO_4}</math>
SO3 характеризуется сильными окислительными свойствами, обычно восстанавливается до диоксида серы:
- <math>\mathsf{5SO_3 + 2P \rightarrow P_2O_5 + 5SO_2}</math>
- <math>\mathsf{3SO_3 + H_2S \rightarrow 4SO_2 + H_2O}</math>
- <math>\mathsf{2SO_3 + 2KI \rightarrow SO_2 + I_2 + K_2SO_4}</math>
При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
- <math>\mathsf{SO_3 + HCl \rightarrow HSO_3Cl}</math>
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
- <math>\mathsf{SO_3 + Cl_2 + 2SCl_2 \rightarrow 3SOCl_2}</math>
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Также серный ангидрид выделяется в воздух при сжигании серных шашек, применяющихся при обеззараживании помещений. При контакте с влажными поверхностями серный ангидрид превращается в серную кислоту, которая уже уничтожает грибок и прочие вредоносные организмы.
Напишите отзыв о статье "Оксид серы(VI)"
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
| ||||||
Отрывок, характеризующий Оксид серы(VI)
Наташа вспыхнула. – Я не хочу ни за кого замуж итти. Я ему то же самое скажу, когда увижу.– Вот как! – сказал Ростов.
– Ну, да, это всё пустяки, – продолжала болтать Наташа. – А что Денисов хороший? – спросила она.
– Хороший.
– Ну и прощай, одевайся. Он страшный, Денисов?
– Отчего страшный? – спросил Nicolas. – Нет. Васька славный.
– Ты его Васькой зовешь – странно. А, что он очень хорош?
– Очень хорош.
– Ну, приходи скорей чай пить. Все вместе.
И Наташа встала на цыпочках и прошлась из комнаты так, как делают танцовщицы, но улыбаясь так, как только улыбаются счастливые 15 летние девочки. Встретившись в гостиной с Соней, Ростов покраснел. Он не знал, как обойтись с ней. Вчера они поцеловались в первую минуту радости свидания, но нынче они чувствовали, что нельзя было этого сделать; он чувствовал, что все, и мать и сестры, смотрели на него вопросительно и от него ожидали, как он поведет себя с нею. Он поцеловал ее руку и назвал ее вы – Соня . Но глаза их, встретившись, сказали друг другу «ты» и нежно поцеловались. Она просила своим взглядом у него прощения за то, что в посольстве Наташи она смела напомнить ему о его обещании и благодарила его за его любовь. Он своим взглядом благодарил ее за предложение свободы и говорил, что так ли, иначе ли, он никогда не перестанет любить ее, потому что нельзя не любить ее.
– Как однако странно, – сказала Вера, выбрав общую минуту молчания, – что Соня с Николенькой теперь встретились на вы и как чужие. – Замечание Веры было справедливо, как и все ее замечания; но как и от большей части ее замечаний всем сделалось неловко, и не только Соня, Николай и Наташа, но и старая графиня, которая боялась этой любви сына к Соне, могущей лишить его блестящей партии, тоже покраснела, как девочка. Денисов, к удивлению Ростова, в новом мундире, напомаженный и надушенный, явился в гостиную таким же щеголем, каким он был в сражениях, и таким любезным с дамами и кавалерами, каким Ростов никак не ожидал его видеть.
Вернувшись в Москву из армии, Николай Ростов был принят домашними как лучший сын, герой и ненаглядный Николушка; родными – как милый, приятный и почтительный молодой человек; знакомыми – как красивый гусарский поручик, ловкий танцор и один из лучших женихов Москвы.
Знакомство у Ростовых была вся Москва; денег в нынешний год у старого графа было достаточно, потому что были перезаложены все имения, и потому Николушка, заведя своего собственного рысака и самые модные рейтузы, особенные, каких ни у кого еще в Москве не было, и сапоги, самые модные, с самыми острыми носками и маленькими серебряными шпорами, проводил время очень весело. Ростов, вернувшись домой, испытал приятное чувство после некоторого промежутка времени примеривания себя к старым условиям жизни. Ему казалось, что он очень возмужал и вырос. Отчаяние за невыдержанный из закона Божьего экзамен, занимание денег у Гаврилы на извозчика, тайные поцелуи с Соней, он про всё это вспоминал, как про ребячество, от которого он неизмеримо был далек теперь. Теперь он – гусарский поручик в серебряном ментике, с солдатским Георгием, готовит своего рысака на бег, вместе с известными охотниками, пожилыми, почтенными. У него знакомая дама на бульваре, к которой он ездит вечером. Он дирижировал мазурку на бале у Архаровых, разговаривал о войне с фельдмаршалом Каменским, бывал в английском клубе, и был на ты с одним сорокалетним полковником, с которым познакомил его Денисов.
Страсть его к государю несколько ослабела в Москве, так как он за это время не видал его. Но он часто рассказывал о государе, о своей любви к нему, давая чувствовать, что он еще не всё рассказывает, что что то еще есть в его чувстве к государю, что не может быть всем понятно; и от всей души разделял общее в то время в Москве чувство обожания к императору Александру Павловичу, которому в Москве в то время было дано наименование ангела во плоти.
В это короткое пребывание Ростова в Москве, до отъезда в армию, он не сблизился, а напротив разошелся с Соней. Она была очень хороша, мила, и, очевидно, страстно влюблена в него; но он был в той поре молодости, когда кажется так много дела, что некогда этим заниматься, и молодой человек боится связываться – дорожит своей свободой, которая ему нужна на многое другое. Когда он думал о Соне в это новое пребывание в Москве, он говорил себе: Э! еще много, много таких будет и есть там, где то, мне еще неизвестных. Еще успею, когда захочу, заняться и любовью, а теперь некогда. Кроме того, ему казалось что то унизительное для своего мужества в женском обществе. Он ездил на балы и в женское общество, притворяясь, что делал это против воли. Бега, английский клуб, кутеж с Денисовым, поездка туда – это было другое дело: это было прилично молодцу гусару.
