Протеинкиназы
|
|
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы (серин, треонин и тирозин) или гетероциклической аминогруппы гистидина.
Фосфорилирование, как правило, изменяет или модифицирует функции субстрата, при этом может изменяться ферментативная активность, положение белка в клетке, или взаимодействие с другими белками. Полагают, что до 30 % всех белков в клетках животных могут быть модифицированы протеинкиназами. В клетке протеинкиназы регулируют метаболические пути, а также пути сигнальной трансдукции и передачи сигналов внутри клетки.
Геном человека содержит около пятисот генов протеинкиназ, которые составляют около двух процентов всех генов.[1]
Химическая активность протеинкиназ заключается в отщеплении фосфатной группы от АТФ и ковалентном присоединении её к остатку одной из трех аминокислот, которые имеют гидроксильные группы. Протеинкиназы оказывают значительный эффект на жизнедеятельность клетки и их активность тщательно регулируется фосфорилированием (в том числе и самофосфорилированием), связыванием с белками-активаторами или белками-ингибиторами и малыми молекулами.
Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения работы протеинкиназ приводят к различным патологиям, в том числе, к возникновению некоторых видов рака.[2][3] Для лечения опухолей такой этиологии разрабатывают лекарства, ингибирующие специфические протеинкиназы.[4]
Протеинкиназы классифицируют по остаткам фосфорилируемых аминокислот. Выделяют протеинкиназы, специфичные к остаткам серина и треонина; тирозина; протеинкиназы двойной специфичности (фосфорилирующие остатки трех аминокислот); а также гистидин-специфичные протеинкиназы прокариот.
Тирозиновые протеинкиназы
 Тирозиновые протеинкиназы — ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке.[5] Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные (связанные с рецептором).[6]
Тирозиновые протеинкиназы — ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке.[5] Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные (связанные с рецептором).[6]
Цитоплазматические протеинкиназы
Геном человека содержит 32 гена цитоплазматических тирозиновых протеинкиназ (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.10.2 2.7.10.2]). Первым изученным геном тирозинкиназы, не связанной с рецептором, был ген из семейства Src, протоонкогенных тирозиновых киназ. Протеинкиназы этого семейства содержатся почти во всех клетках животных. Было показано, что вирус саркомы Рауса (англ.) (RSV) содержит мутантную копию нормального клеточного гена Src. Белки семейства Src регулируют многие процессы в клетке, участвуют в передаче интегрин-зависимых сигналов в клетку, которые побуждают её деление.
Геном ретровирусов (в том числе и вируса саркомы Рауса) может содержать ген v-src (viral-sarcoma), который является онкогеном, он не содержит С-концевого участка, ингибирования фосфорилирования, и поэтому постоянно активен в клетке, чем отличается от c-src (клеточного гена), которые активируется только некоторыми внешними сигналами (например, факторами роста), и является протоонкогеном.[7][8][9][10]
TCR (T-cell receptor, рецептор антигена Т-лимфоцитов), передает сигнал внутрь клетки путём активирования двух белков Lck и Fyn, относящихся к семейству Src. Этот сигнал приводит к пролиферации Т-лимфоцитов и усилению клеточного иммунитета.
Рецепторы с тирозинкиназной активностью
Геном человека содержит 58 генов рецепторов-тирозинкиназ[11] (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.10.1 2.7.10.1]). Гормоны и факторы роста, которые взаимодействуют на поверхности клетки с рецепторами, обладающими тирозинкиназной акитвностью, как правило, вызывают рост клеток и стимулируют клеточные деления (например, инсулин, инсулиноподобный фактор роста 1, эпидермальный фактор роста). Рецепторы с тирозинкиназной активностью располагаются на поверхности клеток и связывают полипептидные факторы роста, цитокины и гормоны. Такие рецепторы не только регулируют клеточные процессы, но и играют критическую роль в развитии многих видов рака.[12]
Рецепторы с тирозинкиназной активностью по фосфорилируемому субстрату делят на двадцать семейств (эпителиального фактора роста, инсулина, фактора роста тромбоцитов и другие).[11] Инсулиновый рецептор является мультимерным комплексом, однако большинство рецепторов с тирозинкиназной активностью имеют только одну субъединицу. Каждый мономер имеет один трансмембранный домен, состоящий из 25-38 аминокислотных остатков, внеклеточный N-концевой домен и внутриклеточный C-концевой домен. Внеклеточный домен очень крупный и отвечает за связывание эндогенных лигандов-агонистов (факторов роста или гормонов), внутриклеточный участок содержит домены с киназной активностью. Когда фактор роста или гормон соединяется с внеклеточным доменом рецептора-тирозинкиназы, рецептор димеризуется. Димеризация рецепторов активирует цитоплазматические домены, которые осуществляют самофосфорилирование рецептора по многим аминокислотным остаткам.
Тирозиновые протеинкиназы принимают участие в передаче сигнала в клетке путём фосфорилирования специфических остатков тирозина белков-мишеней.[13] Специфические белки, содержащие SH2-домены или домены связывания фосфотирозина (Src, фосфолипаза Сγ), соединяются с рецептором и фосфорилируются внутриклеточным доменом. Фосфорилирование приводит к активации белков и инициирует пути сигнальной трансдукции.[13] Активированные рецепторы могут взаимодействовать и с другими белками, не обладающими каталитическими активностями. Такие адапторные белки (scaffold proteins) связывают рецепторы-тирозинкиназы со следующими этапами сигнальной трансдукции, например, с каскадом МАР-киназ.[14]
Серин/треонин — специфичные протеинкиназы

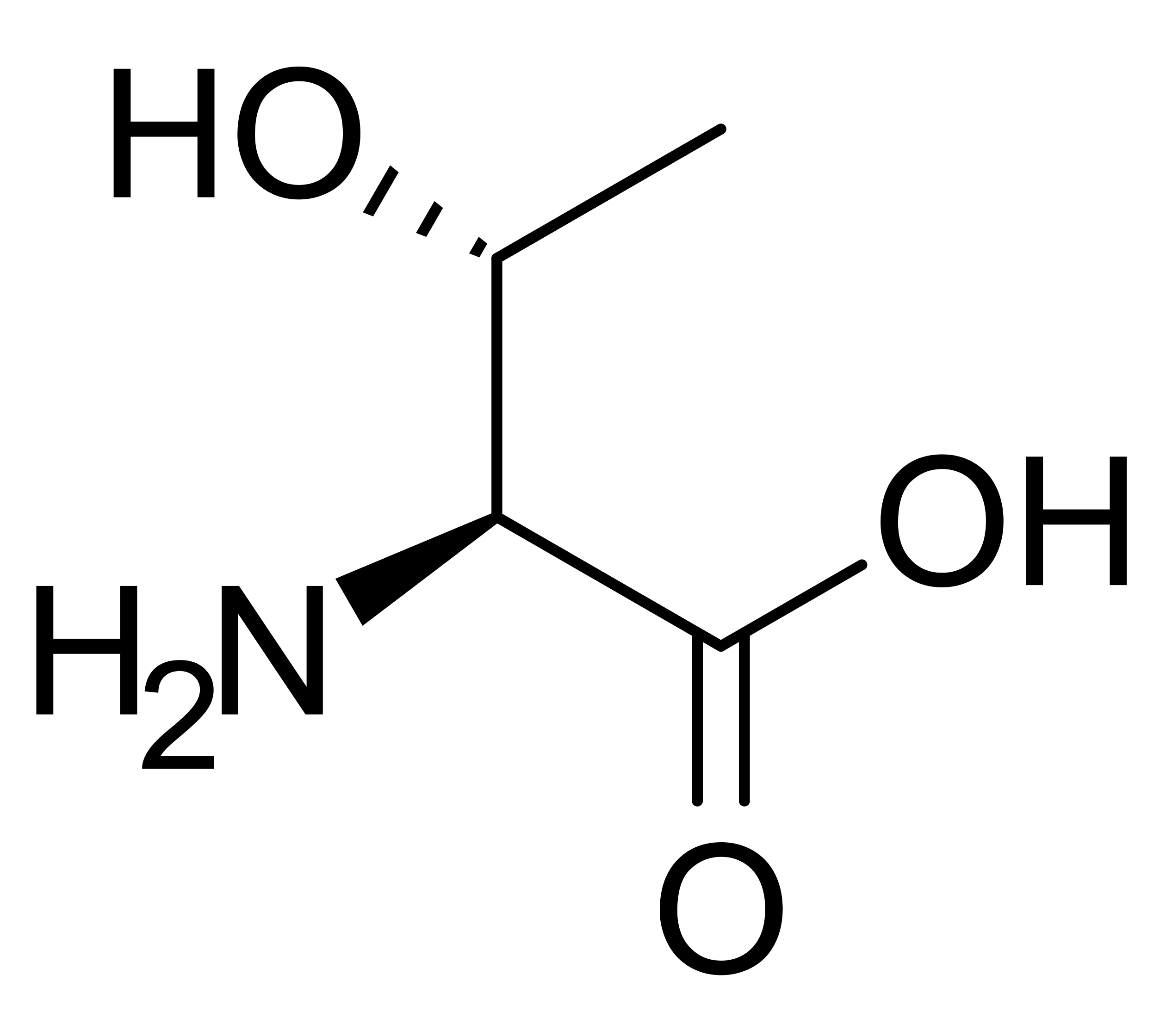 Серин-треониновые протеинкиназы (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.1 2.7.11.1]) фосфоририруют гидроксильную группу в остатках серина или треонина. Активность этих протеинкиназ регулируется несколькими событиями (например, повреждениями ДНК), а также некоторыми химическими сигналами, в том числе, cAMP, cGMP, диацилглицеролом, Ca2+кальмодулином.[6][15]
Серин-треониновые протеинкиназы (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.1 2.7.11.1]) фосфоририруют гидроксильную группу в остатках серина или треонина. Активность этих протеинкиназ регулируется несколькими событиями (например, повреждениями ДНК), а также некоторыми химическими сигналами, в том числе, cAMP, cGMP, диацилглицеролом, Ca2+кальмодулином.[6][15]
Серин/треониновые протеинкиназы фосфорилируют остатки серина или треонина в консенсусных последовательностях, которые образуют фосфоакцепторный сайт. Эта последовательность остатков аминокислот в молекуле субстрата, позволяет осуществлять контакт каталитической щели протеинкиназы с фосфорилируемой областью. Эта особенность делает киназу специфичной не к какому-либо определенному субстрату, но к специфичному семейству белков с одинаковыми консенсусными последовательностями. В то время, как каталитические домены этих протеинкиназ высококонсервативны, последовательности узнавания отличаются, обуславливая узнавание разных субстратов.[6]
Киназа фосфорилазы (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.19 2.7.11.19]) была открыта Кребсом в 1959 году[16] и является первым описанным ферментом семейства серин/треониновых протеинкиназ. Киназа фосфорилазы превращает неактивную гликогенфосфорилазу В в активную форму гликогенфосфорилазу A, последняя отщепляет от гликогена остатки глюкозо-1-фосфата. Киназа фосфорилазы активируется протеинкиназой А.
Протеинкиназа А
Протеинкиназа А, или цАМФ-зависимая протеинкиназа, (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.1 2.7.11.1]) относится к семейству ферментов, активность которых зависит от уровня циклического АМФ (цАМФ) в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, её функции разнообразны, она участвует в регуляции метаболизма гликогена, липидов и сахаров, её субстратами могут быть другие протеинкиназы или другие метаболические ферменты. Её следует отличать от АМФ-зависимой протеинкиназы, или АМФК, которая играет важную роль в поддержании энергетического баланса клетки и активируется посредством АМФ, а не цАМФ.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая фосфорилирует транскрипционный фактор CREB по остатку серина 133, CREB связывает своим фосфорилированным участком коактиватор транскрипции и стимулирует транскрипцию.
Молекула протеинкиназы А является холоферментом (то есть требует кофермент для работы) и в неактивном состоянии является тетрамером — состоит из двух регуляторных и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, холофермент остается интактным и каталитическая активность отсутствует. Когда концентрация цАМФ в клетке возрастает (если активируется аденилатциклаза рецепторами, связанными с G-белками, или ингибируются фосфодиэстеразы, расщепляющие цАМФ), цАМФ связывается с двумя сайтами связывания на регуляторных субъединицах, происходят конформационные изменения, диссоциация тетрамера на два каталитически активных димера (состоящих из одной каталитической и одной регуляторной субъединицы). Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина.
Протеинкиназы А представлены в многих типах клеток, и проявляют каталитические активности в отношении разных субстратов, поэтому, работа протеинкиназы А и концентрация цАМФ регулируется во многих биохимических путях. Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилирует мишени.
Гормоны инсулин и глюкагон влияют на работу протеинкиназы А, изменяя уровень цАМФ в клетке по механизму активации рецепторов, связанных с G-белками (инсулин действует через тирозинкиназу), через аденилатциклазу. Инсулин активирует аденилатциклазу, повышая концентрацию цАМФ, протеинкиназа А фосфорилирует ферменты ацетил-КоА-карбоксилазу и пируватдегидрогеназу, направляя таким образом ацетил-КоА для синтеза липидов; глюкагон имеет противоположный эффект.
Работа протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая превращает цАМФ в АМФ, таким образом, снижая концентрацию цАМФ и ингибируя протеинкиназу А.
Протеинкиназа B (Akt)
Геном человека содержит семейство генов Akt1, Akt2, Akt3. Протеинкиназа Akt1 ингибирует процессы апоптоза, принимает участие в регуляции клеточного цикла, индуцирует синтез белка и поэтому является ключевым белком, регулирующим рост тканей, а также отвечает за развитие мышечной гипертрофии. Поскольку продукт гена Akt1 блокирует апоптоз, повышенный уровень экспрессии Akt1 отмечается во многих опухолях. Первоначально Akt1 был охарактеризован как онкоген в трансформирующем ретровирусе AKT8 в 1990 году.
Продукт гена Akt2 является важной сигнальной молекулой в пути передачи сигнала молекулой инсулина, этот белок требуется для транспорта глюкозы.
Показано, что Akt3 преимущественно экспрессируется в мозге. Мыши, лишенные гена Akt3, имеют маленький мозг. Мыши, нокаутные по гену Akt1, но имеющие ген Akt2 имели меньший размер. Так как уровень глюкозы у таких мышей был в норме, была показана роль Akt1 в процессах роста.[17]
Мыши, нокаутные по гену Akt2, но имеющие Akt1, имели задержки роста и фенотипические проявления инсулин-зависимого диабета. Полученные данные указывали на роль Akt2 в проведении сигнала от инсулинового рецептора.[18]
Регуляция активности Akt осуществляется путём связывания фосфолипидов в мембране. Akt содержит PH-домен (Pleckstrin Homology domain, 120 остатков аминокислот), который высокоаффинно связывает фосфатидилинозитол-трифосфат (PIP3) или фосфатидилинозитол-дифосфат (PIP2). PH-домены выполняют функции заякоривания в мембранах. PIP2 может быть фосфорилирован только PIP3-киназами, и только в случае, когда клетка получила сигнал к росту. PIP3-киназы могут быть активированы рецепторами, связанными с G-белками или рецепторами с тирозинкиназной активностью (например, инсулиновым рецептором). Только после активации PIP3-киназы фосфорилируют PIP2 в PIP3.[19]
После связывания с PIP3 и закрепления в мембране Akt может быть активирована путём фосфорилирования фосфоинозитол-зависимыми киназами (PDK1 и PDK2, mTORC2). PDK1 фосфорилирует Akt, mTORC2 стимулирует фосфорилирование PDK1. Активированная Akt далее регулирует фосфорилированием активность многих субстратов. Показано, что Akt может быть активирована и без участия PIP3-киназ.
Соединения, повышающие концентрацию цАМФ могут активировать Akt через протеинкиназу А. Фосфатазы липидов контролируют концентрацию PIP3, например, супрессор опухолей PTEN (phosphatase and tensin homolog deleted on chromosome ten) работает как фосфатаза, и дефосфорилирует PIP3 в PIP2. Akt диссоциирует от плазматической мембраны и активность фермента значительно падает. Протеинфосфатазы контролируют количество фосфорилированного Akt. Фосфатазы PHLPP (PH domain and leucine rich repeat protein phosphatase) дефосфорилируют серин 473 в Akt и тем самым инактивируют её.[20]
Akt регулирует многие процессы, направленные на выживание клетки. Например, Akt может фосфорилировать про-апоптотический белок BAD (из семейства Bcl-2) по остатку серина 136, что вызывает диссоциацию BAD из Bcl-2/Bcl-X комплекса и приводит к утере про-апоптотической функции. Также Akt активирует транскрипционный фактор NF-κB (nuclear factor-kappa B), и включает транскрипцию генов выживания.
Akt требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 (GLUT 4) в плазматическую мембрану. Киназа-3 гликогенсинтетазы (GSK 3) может быть ингибирована фосфорилированием Akt, что вызывает синтез гликогена.
Akt1 также связана с ростом сосудов и развитием опухолей. Недостаточность Akt1 у мышей ингибирует физиологический ангиогенез, но усиливает патологический рост сосудов и опухолей.[21]
Протеинкиназа С
Протеинкиназы С (PKC, КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.13 2.7.11.13]) — это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические (англ. conventional), оригинальные (англ. novel), или нестандартные и нетипичные (англ. atypical). Традиционным протеинкиназам С для активации требуется Ca2+, диацилглицерол или фосфатидилхолин. Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca2+. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca2+, ни диацилглицерола для активации.
Все ферменты семейства протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновых протеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках.
Регуляторный домен на N-конце протеинкиназы С содержит отдельные участки. С1 домен, представленный во всех изоформах протеинкиназы С, имеет сайт связывания диацилглицерола. С2 домен воспринимает ион Ca2+. Район псевдосвязывания субстрата представляет собой короткую последовательность аминокислот, которые подражают субстрату и занимают участок связывания субстрата в активном центре, делая фермент неактивным.
Ca2+ и диацилглицерол (DAG) связываются с доменами С2 и С1, соответственно, и вызывают прикрепление протеинкиназы С к плазматической мембране. Взаимодействие с мембраной вызывает освобождение псевдосубстрата из каталитического центра и активирует фермент. Для осуществления подобных аллостерических взаимодействий, протеинкиназе С требуется предварительное фосфорилирование каталитического района.
Протеинкиназа С должна быть предварительно фосфорилирована и для осуществления собственной киназной активности. Молекула протеинкиназы С содержит несколько сайтов фосфорилирования 3-фосфоинозитол-зависимой протеинкиназой-1 (PDK1). После активации протеинкиназа С переносится к плазматической мембране и присоединяются к RACK-белкам (англ. Receptor for Activated C-Kinase), аминокислотная последовательность которых на 47 % гомологична бета-субъединицам G-белков.
Для протеинкиназ С характерен длительный период активности, которая сохраняется, даже если первоначальный сигнал пропал или снизилась концентрация ионов Ca2+. Это достигается образованием диацилглицерола из фосфатидилхолина с помощью фосфолипазы С.
Последовательность остатков аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы, Raf-киназы, MARCKS (англ. myristoylated alanine-rich C-kinase substrate, производные миристоленовой кислоты, богатые аланином, субстраты протеинкиназы С). Белки-субстраты протеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS — кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаны N-концом с липидами мембраны (через миристоленовую кислоту), регулируются ионами Ca2+, кальмодулином, протеинкиназой С.
VDR (Vitamin D receptor) — кальцитриоловый рецептор. Рецептор стероидных гормонов из семейства ядерных рецепторов. После активирования молекулой витамина D, образует гетеродимер с ретиноидным-Х-рецептором и связывается с регуляторными элементами на ДНК, изменяя экспрессию генов или снимая репрессоры генов. Глюкокортикоиды снижают экспрессию VDR во всех тканях.
Рецептор эпидермального фактора роста (EGFR) — относится к семейству рецепторов факторов роста, связывающих внеклеточные белковые лиганды и обладает тирозинкиназными активностями. Мутации, затрагивающие EGRF часто могут проявляться в раковом перерождении клетки. После связывания лиганда, рецептор димеризуется, происходит самофосфорилирование по пяти остаткам тирозина на С-конце рецептора, и EGRF приобретает внутриклеточную тирозинкиназную активность.[22]
Последующая активность EGRF связана с инициацией каскада сигнальной трансдукции, активируются MAPK, Akt, JNK — что приводит к синтезу ДНК и пролиферации. Киназный домен также может фосфорилировать другие рецепторы, связанные с EGRF по остаткам тирозина.
Ca2+/кальмодулин — зависимые протеинкиназы
 Са2+/кальмодулин-зависимые киназы, или СаМ киназы, (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.17 2.7.11.17]) регулируются Са2+/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы (например, киназа легких цепей миозина, которая фосфорилирует молекулы миозина, вызывая мышечное сокращение) и многофункциональные СаМ киназы (играют роль во многих процессах: секреции нейромедиаторов, регуляции транскрипционных факторов, в метаболизме гликогена), порядка 2 % белков головного мозга представлены СаМ второго типа.[23]
Са2+/кальмодулин-зависимые киназы, или СаМ киназы, (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.17 2.7.11.17]) регулируются Са2+/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы (например, киназа легких цепей миозина, которая фосфорилирует молекулы миозина, вызывая мышечное сокращение) и многофункциональные СаМ киназы (играют роль во многих процессах: секреции нейромедиаторов, регуляции транскрипционных факторов, в метаболизме гликогена), порядка 2 % белков головного мозга представлены СаМ второго типа.[23]
Кальмодулин (СаМ) — это вездесущий, кальций-связывающий белок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция.[24]
СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл.[25] Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала.
 Кальмодулин также используется для запасания Ca2+ в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырёх ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ.
Кальмодулин также используется для запасания Ca2+ в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырёх ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ.
Киназа легких цепей миозина. Киназа легких цепей миозина (MLCK) фосфорилирует миозин. Киназа легких цепей миозина имеет ключевое значение в сокращении гладкой мускулатуры.[26] Сокращение гладких мышц может произойти после повышения концентрации кальция в результате притока из саркоплазматического ретикулюма или из внеклеточного пространства. Сперва кальций связывается с кальмодулином, это связывание активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи молекул миозина. Фосфорилирование позволяет молекулам миозина образовывать поперечные мостики и связываться с актиновыми филаментами и стимулирует мышечное сокращение. Данный путь является основным в механизме сокращения гладких мышц, так как гладкие мышцы не содержат тропонинового комплекса, в отличие от поперечно-полосатых.
МАРK (митоген-активируемые киназы)
 Митоген-активируемые киназы (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.24 2.7.11.24]) отвечают на внеклеточные стимулы (митогены) и регулируют многие клеточные процессы (экспрессию генов, деление, дифференцировку и апоптоз). МАРК вовлечены в работу многих неядерных белков — продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК (МАР2К) и МАРККК (МАР3К). МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАРK-каскад консервативен для эукариот от дрожжей до млекопитающих.
Митоген-активируемые киназы (КФ [www.expasy.org/cgi-bin/nicezyme.pl?2.7.11.24 2.7.11.24]) отвечают на внеклеточные стимулы (митогены) и регулируют многие клеточные процессы (экспрессию генов, деление, дифференцировку и апоптоз). МАРК вовлечены в работу многих неядерных белков — продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК (МАР2К) и МАРККК (МАР3К). МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАРK-каскад консервативен для эукариот от дрожжей до млекопитающих.
MAPK/ERK-киназы принимают участие в особом пути сигнальной трансдукции. ERK — или классические МАР-киназы, регулируются внеклеточными сигналами.[27]
Рецепторы, связанные с тирозиновыми киназами (например, EGFR), активируются внеклеточными лигандами. Связывание EGF с рецептором приводит к фосфорилированию EGFR. Белок GRB2, содержащий SH2-домен, связывается с остатками фосфорилированного тирозина. Белок GRB2 своим SH3-доменом связывается и активирует SOS (гуанин-нуклеотид заменяющим фактором). Активированный гуанин-нуклеотид заменяющий фактор отщепляет ГДФ от белка Ras,[28] Ras далее может связать ГТФ и активироваться.
Активный Ras активирует RAF-киназу (серин-треониновой специфичности). RAF-киназа фосфорилирует и активирует МЕК, другую серин-треониновую киназу. МЕК фосфорилирует и активирует МАРК. Эта серия киназ от RAF к МЕК и к МАРК является примером каскада протеинкиназ.[29]
Один из эффектов активации МАРК это изменение трансляции мРНК. МАРК фосфорилирует и активирует S6 киназу 40S рибосомных белков (RSK). RSK фосфорилирует рибосомный белок S6, и вызывает его диссоциацию от рибосомы.
МАРК регулирует активности нескольких транскрипционных факторов, например, C-myc. МАРК регулирует активность генов, контролирующих клеточный цикл.[27]
Гистидин — специфичные протеинкиназы
Гистидиновые киназы найдены в прокариотах и по своей структуре отличаются от других известных протеинкиназ.[30] У прокариот гистидин-специфичные протеинкиназы работают как часть двухкомпонентной системы сигнальной трансдукции. В ходе фосфорилирования неорганический фосфат отщепляется от АТФ и присоединяется к собственному остатку гистидина, а затем переносится на остаток аспартата белка-мишени. Фосфорилирование аспартата приводит к дальнейшей передаче сигнала.
Гистидиновые киназы широко распространены среди прокариот, растений и грибов. Фермент пируватдегидрогеназа животных, относящийся к семейству протеинкиназ, структурно повторяет гистидиновые киназы, но фосфорилирует остатки серина, и, возможно, не использует гистидин-фосфатный интермедиат.[30]
См. также
Напишите отзыв о статье "Протеинкиназы"
Примечания
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). «[www.bentham-direct.org/pages/content.php?CPD/2004/00000010/00000010/0002B.SGM High-throughput structural biology in drug discovery: protein kinases]». Curr. Pharm. Des. 10 (10): 1069–82. PMID 15078142.
- ↑ Capra M., Nuciforo P. G., Confalonieri S., Quarto M., Bianchi M., Nebuloni M., Boldorini R., Pallotti F., Viale G., Gishizky M. L., Draetta G. F., Di Fiore P. P. [www.ncbi.nlm.nih.gov/pubmed/16912193 Frequent alterations in the expression of serine/threonine kinases in human cancers.] (англ.) // Cancer research. — 2006. — Vol. 66, no. 16. — P. 8147—8154. — DOI:10.1158/0008-5472.CAN-05-3489. — PMID 16912193.
- ↑ Clark D. E., Errington T. M., Smith J. A., Frierson H. F. Jr., Weber M. J., Lannigan D. A. [www.ncbi.nlm.nih.gov/pubmed/15833840 The serine/threonine protein kinase, p90 ribosomal S6 kinase, is an important regulator of prostate cancer cell proliferation.] (англ.) // Cancer research. — 2005. — Vol. 65, no. 8. — P. 3108—3116. — DOI:10.1158/0008-5472.CAN-04-3151. — PMID 15833840.
- ↑ Zhao Y, Thomas HD, Batey MA, et al (May 2006). «[cancerres.aacrjournals.org/cgi/pmidlookup?view=long&pmid=16707462 Preclinical evaluation of a potent novel DNA-dependent protein kinase inhibitor NU7441]». Cancer Res. 66 (10): 5354–62. DOI:10.1158/0008-5472.CAN-05-4275. PMID 16707462.
- ↑ Weinberg Robert A. The Biology Of Cancer. — New York: Garland Science, Taylor & Francis Group, LLC. — P. 757–759. — ISBN 0-8153-4076-1.
- ↑ 1 2 3 Cox, Michael; Nelson, David R. Lehninger: Principles of Biochemistry. — fifth. — W H Freeman & Co, 2008. — ISBN 1-4292-2416-9.
- ↑ Cance WG, Craven RJ, Bergman M, Xu L, Alitalo K, Liu ET (December 1994). «Rak, a novel nuclear tyrosine kinase expressed in epithelial cells». Cell Growth Differ. 5 (12): 1347–55. PMID 7696183.
- ↑ Lee J, Wang Z, Luoh SM, Wood WI, Scadden DT (January 1994). «Cloning of FRK, a novel human intracellular SRC-like tyrosine kinase-encoding gene». Gene 138 (1–2): 247–51. DOI:10.1016/0378-1119(94)90817-6. PMID 7510261.
- ↑ Oberg-Welsh C, Welsh M (January 1995). «Cloning of BSK, a murine FRK homologue with a specific pattern of tissue distribution». Gene 152 (2): 239–42. DOI:10.1016/0378-1119(94)00718-8. PMID 7835707.
- ↑ Thuveson M, Albrecht D, Zürcher G, Andres AC, Ziemiecki A (April 1995). «iyk, a novel intracellular protein tyrosine kinase differentially expressed in the mouse mammary gland and intestine». Biochem. Biophys. Res. Commun. 209 (2): 582–9. DOI:10.1006/bbrc.1995.1540. PMID 7733928.
- ↑ 1 2 Robinson DR, Wu YM, Lin SF. (2000). «The protein tyrosine kinase family of the human genome». Oncogene 19 (49): 5548–5557. DOI:10.1038/sj.onc.1203957. PMID 11114734.
- ↑ Zwick, E. Bange, J. Ullrich, A. (2001). «Receptor tyrosine kinase signalling as a target for cancer intervention strategies». Endocr. Relat. Cancer 8 (3): 161–173. DOI:10.1677/erc.0.0080161. PMID 11566607.
- ↑ 1 2 Pawson, T. (1995). «Protein modules and signalling networks». Nature 373 (6515): 573–580. DOI:10.1038/373573a0. PMID 7531822.
- ↑ Avruch J, Khokhlatchev A, Kyriakis JM, et al. (2001). «[rphr.endojournals.org/cgi/pmidlookup?view=long&pmid=11237210 Ras activation of the Raf kinase: tyrosine kinase recruitment of the MAP kinase cascade]». Recent Progress in Hormone Research 56 (1): 127–55. DOI:10.1210/rp.56.1.127. PMID 11237210.
- ↑ Walter F., PhD. Boron. Medical Physiology: A Cellular And Molecular Approach. — Elsevier/Saunders. — ISBN 1-4160-2328-3.
- ↑ Edwin G. Krebs , David S. Love , Gloria E. Bratvold , Kenneth A. Trayser , William L. Meyer , Edmond H. Fischer Purification and Properties of Rabbit Skeletal Muscle Phosphorylase b Kinase // Biochemistry. — 1964. — Т. 3, вып. 8. — С. 1022–1033. — DOI:10.1021/bi00896a003.
- ↑ Easton RM, Cho H, Roovers K, Shineman DW, Mizrahi M, Forman MS, Lee VM, Szabolcs M, de Jong R, Oltersdorf T, Ludwig T, Efstratiadis A, Birnbaum MJ Role for Akt3/protein kinase Bgamma in attainment of normal brain size // Mol Cell Biol. — 2005. — Т. 25, № 5. — С. 1869-78. — PMID 15713641.
- ↑ McCurdy CE, Cartee GD Akt2 is essential for the full effect of calorie restriction on insulin-stimulated glucose uptake in skeletal muscle // Diabetes. — 2005. — Т. 54, № 5. — С. 1349-56. — PMID 15855319.
- ↑ Северин Е. С. Биохимия. — 5-е. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3.
- ↑ Brognard J, Sierecki E, Gao T, Newton AC PHLPP and a second isoform, PHLPP2, differentially attenuate the amplitude of Akt signaling by regulating distinct Akt isoforms // Mol Cell. — 2007. — Т. 25, № 6. — С. 917-31. — PMID 17386267.
- ↑ Qiao M, Sheng S, Pardee AB Metastasis and AKT activation // Cell Cycle. — 2008. — Т. 7, № 19. — С. 2991-6. — PMID 18818526.
- ↑ Carpenter G. [www.ncbi.nlm.nih.gov/pubmed/10918300 The EGF receptor: a nexus for trafficking and signaling.] (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2000. — Vol. 22, no. 8. — P. 697—707. — DOI:10.1002/1521-1878(200008)22:8<697::AID-BIES3>3.0.CO;2-1. — PMID 10918300.
- ↑ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (December 2002). «The protein kinase complement of the human genome». Science (journal) 298 (5600): 1912–34. DOI:10.1126/science.1075762. PMID 12471243.
- ↑ Chin D, Means AR (2000). «Calmodulin: a prototypical calcium sensor». Trends Cell Biol. 10 (8): 322–8. DOI:10.1016/S0962-8924(00)01800-6. PMID 10884684.
- ↑ Stevens FC (1983). «Calmodulin: an introduction». Can. J. Biochem. Cell Biol. 61 (8): 906–10. PMID 6313166.
- ↑ Gao Y, Ye LH, Kishi H, Okagaki T, Samizo K, Nakamura A, Kohama K (June 2001). «Myosin light chain kinase as a multifunctional regulatory protein of smooth muscle contraction». IUBMB Life 51 (6): 337–44. PMID 11758800.
- ↑ 1 2 Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH (2001). «Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions». Endocr. Rev. 22 (2): 153–83. DOI:10.1210/er.22.2.153. PMID 11294822.
- ↑ Bonni A, Brunet A, West AE, Datta SR, Takasu MA, Greenberg ME (1999). «Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and -independent mechanisms». Science 286 (5443): 1358–62. DOI:10.1126/science.286.5443.1358. PMID 10558990.
- ↑ Hazzalin CA, Mahadevan LC (2002). «MAPK-regulated transcription: a continuously variable gene switch?». Nat. Rev. Mol. Cell Biol. 3 (1): 30–40. DOI:10.1038/nrm715. PMID 11823796.
- ↑ 1 2 Besant PG, Tan E, Attwood PV (March 2003). «[linkinghub.elsevier.com/retrieve/pii/S1357272502002571 Mammalian protein histidine kinases]». Int. J. Biochem. Cell Biol. 35 (3): 297–309. DOI:10.1016/S1357-2725(02)00257-1. PMID 12531242.
Литература
- Северин Е. С. Биохимия. — 5-е. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3.
- Gomperts, Tatham, Kramer. Signal transduction. — London: Elsevier Science, 2003. — 424 с. — ISBN 01-12-289631-9.
- Gerhard Krauss. Biochemistry of Signal Transduction and Regulation. — Second edition. — Germany: Wiley-VCH Verlag GmbH, 2001. — 495 с. — ISBN 3-527-30378-2.
Ссылки
- [pkr.genomics.purdue.edu/pkr/ The Protein Kinase Resource] База данных по структуре протеинкиназ
- [kinase.com Kinase.сom] Геномный, эволюционный анализ протеинкиназ
- [www.kinase3d.org/ Kinase3D] трехмерные модели протеинкиназ
- [www.kinasecentral.com Ингибиторы протеинкиназ в развитии]
- [hodgkin.mbu.iisc.ernet.in/~king/ Подборка последовательностей Ser/Thr/Tyr специфичных протеинкиназ и сходных последовательностей]
- [bioinf.uta.fi/KinMutBase/ Реестр мутаций в белковых доменах протеинкиназ, которые вызывают заболевания]
- [www.sciencemag.org/cgi/content/abstract/298/5600/1912 Статья о киноме человека]
- [www.kinasearray.com Метод microarray для определения субстратной специфичности протеинкиназ]
| Эта статья входит в число хороших статей русскоязычного раздела Википедии. |
Отрывок, характеризующий Протеинкиназы
– Да еще какая! – прокричал Денисов. – Молодцами г'аботали! А г'абота сквег'ная! Атака – любезное дело, г'убай в песи, а тут, чог'т знает что, бьют как в мишень.И Денисов отъехал к остановившейся недалеко от Ростова группе: полкового командира, Несвицкого, Жеркова и свитского офицера.
«Однако, кажется, никто не заметил», думал про себя Ростов. И действительно, никто ничего не заметил, потому что каждому было знакомо то чувство, которое испытал в первый раз необстреленный юнкер.
– Вот вам реляция и будет, – сказал Жерков, – глядишь, и меня в подпоручики произведут.
– Доложите князу, что я мост зажигал, – сказал полковник торжественно и весело.
– А коли про потерю спросят?
– Пустячок! – пробасил полковник, – два гусара ранено, и один наповал , – сказал он с видимою радостью, не в силах удержаться от счастливой улыбки, звучно отрубая красивое слово наповал .
Преследуемая стотысячною французскою армией под начальством Бонапарта, встречаемая враждебно расположенными жителями, не доверяя более своим союзникам, испытывая недостаток продовольствия и принужденная действовать вне всех предвидимых условий войны, русская тридцатипятитысячная армия, под начальством Кутузова, поспешно отступала вниз по Дунаю, останавливаясь там, где она бывала настигнута неприятелем, и отбиваясь ариергардными делами, лишь насколько это было нужно для того, чтоб отступать, не теряя тяжестей. Были дела при Ламбахе, Амштетене и Мельке; но, несмотря на храбрость и стойкость, признаваемую самим неприятелем, с которою дрались русские, последствием этих дел было только еще быстрейшее отступление. Австрийские войска, избежавшие плена под Ульмом и присоединившиеся к Кутузову у Браунау, отделились теперь от русской армии, и Кутузов был предоставлен только своим слабым, истощенным силам. Защищать более Вену нельзя было и думать. Вместо наступательной, глубоко обдуманной, по законам новой науки – стратегии, войны, план которой был передан Кутузову в его бытность в Вене австрийским гофкригсратом, единственная, почти недостижимая цель, представлявшаяся теперь Кутузову, состояла в том, чтобы, не погубив армии подобно Маку под Ульмом, соединиться с войсками, шедшими из России.
28 го октября Кутузов с армией перешел на левый берег Дуная и в первый раз остановился, положив Дунай между собой и главными силами французов. 30 го он атаковал находившуюся на левом берегу Дуная дивизию Мортье и разбил ее. В этом деле в первый раз взяты трофеи: знамя, орудия и два неприятельские генерала. В первый раз после двухнедельного отступления русские войска остановились и после борьбы не только удержали поле сражения, но прогнали французов. Несмотря на то, что войска были раздеты, изнурены, на одну треть ослаблены отсталыми, ранеными, убитыми и больными; несмотря на то, что на той стороне Дуная были оставлены больные и раненые с письмом Кутузова, поручавшим их человеколюбию неприятеля; несмотря на то, что большие госпитали и дома в Кремсе, обращенные в лазареты, не могли уже вмещать в себе всех больных и раненых, – несмотря на всё это, остановка при Кремсе и победа над Мортье значительно подняли дух войска. Во всей армии и в главной квартире ходили самые радостные, хотя и несправедливые слухи о мнимом приближении колонн из России, о какой то победе, одержанной австрийцами, и об отступлении испуганного Бонапарта.
Князь Андрей находился во время сражения при убитом в этом деле австрийском генерале Шмите. Под ним была ранена лошадь, и сам он был слегка оцарапан в руку пулей. В знак особой милости главнокомандующего он был послан с известием об этой победе к австрийскому двору, находившемуся уже не в Вене, которой угрожали французские войска, а в Брюнне. В ночь сражения, взволнованный, но не усталый(несмотря на свое несильное на вид сложение, князь Андрей мог переносить физическую усталость гораздо лучше самых сильных людей), верхом приехав с донесением от Дохтурова в Кремс к Кутузову, князь Андрей был в ту же ночь отправлен курьером в Брюнн. Отправление курьером, кроме наград, означало важный шаг к повышению.
Ночь была темная, звездная; дорога чернелась между белевшим снегом, выпавшим накануне, в день сражения. То перебирая впечатления прошедшего сражения, то радостно воображая впечатление, которое он произведет известием о победе, вспоминая проводы главнокомандующего и товарищей, князь Андрей скакал в почтовой бричке, испытывая чувство человека, долго ждавшего и, наконец, достигшего начала желаемого счастия. Как скоро он закрывал глаза, в ушах его раздавалась пальба ружей и орудий, которая сливалась со стуком колес и впечатлением победы. То ему начинало представляться, что русские бегут, что он сам убит; но он поспешно просыпался, со счастием как будто вновь узнавал, что ничего этого не было, и что, напротив, французы бежали. Он снова вспоминал все подробности победы, свое спокойное мужество во время сражения и, успокоившись, задремывал… После темной звездной ночи наступило яркое, веселое утро. Снег таял на солнце, лошади быстро скакали, и безразлично вправе и влеве проходили новые разнообразные леса, поля, деревни.
На одной из станций он обогнал обоз русских раненых. Русский офицер, ведший транспорт, развалясь на передней телеге, что то кричал, ругая грубыми словами солдата. В длинных немецких форшпанах тряслось по каменистой дороге по шести и более бледных, перевязанных и грязных раненых. Некоторые из них говорили (он слышал русский говор), другие ели хлеб, самые тяжелые молча, с кротким и болезненным детским участием, смотрели на скачущего мимо их курьера.
Князь Андрей велел остановиться и спросил у солдата, в каком деле ранены. «Позавчера на Дунаю», отвечал солдат. Князь Андрей достал кошелек и дал солдату три золотых.
– На всех, – прибавил он, обращаясь к подошедшему офицеру. – Поправляйтесь, ребята, – обратился он к солдатам, – еще дела много.
– Что, г. адъютант, какие новости? – спросил офицер, видимо желая разговориться.
– Хорошие! Вперед, – крикнул он ямщику и поскакал далее.
Уже было совсем темно, когда князь Андрей въехал в Брюнн и увидал себя окруженным высокими домами, огнями лавок, окон домов и фонарей, шумящими по мостовой красивыми экипажами и всею тою атмосферой большого оживленного города, которая всегда так привлекательна для военного человека после лагеря. Князь Андрей, несмотря на быструю езду и бессонную ночь, подъезжая ко дворцу, чувствовал себя еще более оживленным, чем накануне. Только глаза блестели лихорадочным блеском, и мысли изменялись с чрезвычайною быстротой и ясностью. Живо представились ему опять все подробности сражения уже не смутно, но определенно, в сжатом изложении, которое он в воображении делал императору Францу. Живо представились ему случайные вопросы, которые могли быть ему сделаны,и те ответы,которые он сделает на них.Он полагал,что его сейчас же представят императору. Но у большого подъезда дворца к нему выбежал чиновник и, узнав в нем курьера, проводил его на другой подъезд.
– Из коридора направо; там, Euer Hochgeboren, [Ваше высокородие,] найдете дежурного флигель адъютанта, – сказал ему чиновник. – Он проводит к военному министру.
Дежурный флигель адъютант, встретивший князя Андрея, попросил его подождать и пошел к военному министру. Через пять минут флигель адъютант вернулся и, особенно учтиво наклонясь и пропуская князя Андрея вперед себя, провел его через коридор в кабинет, где занимался военный министр. Флигель адъютант своею изысканною учтивостью, казалось, хотел оградить себя от попыток фамильярности русского адъютанта. Радостное чувство князя Андрея значительно ослабело, когда он подходил к двери кабинета военного министра. Он почувствовал себя оскорбленным, и чувство оскорбления перешло в то же мгновенье незаметно для него самого в чувство презрения, ни на чем не основанного. Находчивый же ум в то же мгновение подсказал ему ту точку зрения, с которой он имел право презирать и адъютанта и военного министра. «Им, должно быть, очень легко покажется одерживать победы, не нюхая пороха!» подумал он. Глаза его презрительно прищурились; он особенно медленно вошел в кабинет военного министра. Чувство это еще более усилилось, когда он увидал военного министра, сидевшего над большим столом и первые две минуты не обращавшего внимания на вошедшего. Военный министр опустил свою лысую, с седыми висками, голову между двух восковых свечей и читал, отмечая карандашом, бумаги. Он дочитывал, не поднимая головы, в то время как отворилась дверь и послышались шаги.
– Возьмите это и передайте, – сказал военный министр своему адъютанту, подавая бумаги и не обращая еще внимания на курьера.
Князь Андрей почувствовал, что либо из всех дел, занимавших военного министра, действия кутузовской армии менее всего могли его интересовать, либо нужно было это дать почувствовать русскому курьеру. «Но мне это совершенно всё равно», подумал он. Военный министр сдвинул остальные бумаги, сровнял их края с краями и поднял голову. У него была умная и характерная голова. Но в то же мгновение, как он обратился к князю Андрею, умное и твердое выражение лица военного министра, видимо, привычно и сознательно изменилось: на лице его остановилась глупая, притворная, не скрывающая своего притворства, улыбка человека, принимающего одного за другим много просителей.
– От генерала фельдмаршала Кутузова? – спросил он. – Надеюсь, хорошие вести? Было столкновение с Мортье? Победа? Пора!
Он взял депешу, которая была на его имя, и стал читать ее с грустным выражением.
– Ах, Боже мой! Боже мой! Шмит! – сказал он по немецки. – Какое несчастие, какое несчастие!
Пробежав депешу, он положил ее на стол и взглянул на князя Андрея, видимо, что то соображая.
– Ах, какое несчастие! Дело, вы говорите, решительное? Мортье не взят, однако. (Он подумал.) Очень рад, что вы привезли хорошие вести, хотя смерть Шмита есть дорогая плата за победу. Его величество, верно, пожелает вас видеть, но не нынче. Благодарю вас, отдохните. Завтра будьте на выходе после парада. Впрочем, я вам дам знать.
Исчезнувшая во время разговора глупая улыбка опять явилась на лице военного министра.
– До свидания, очень благодарю вас. Государь император, вероятно, пожелает вас видеть, – повторил он и наклонил голову.
Когда князь Андрей вышел из дворца, он почувствовал, что весь интерес и счастие, доставленные ему победой, оставлены им теперь и переданы в равнодушные руки военного министра и учтивого адъютанта. Весь склад мыслей его мгновенно изменился: сражение представилось ему давнишним, далеким воспоминанием.
Князь Андрей остановился в Брюнне у своего знакомого, русского дипломата .Билибина.
– А, милый князь, нет приятнее гостя, – сказал Билибин, выходя навстречу князю Андрею. – Франц, в мою спальню вещи князя! – обратился он к слуге, провожавшему Болконского. – Что, вестником победы? Прекрасно. А я сижу больной, как видите.
Князь Андрей, умывшись и одевшись, вышел в роскошный кабинет дипломата и сел за приготовленный обед. Билибин покойно уселся у камина.
Князь Андрей не только после своего путешествия, но и после всего похода, во время которого он был лишен всех удобств чистоты и изящества жизни, испытывал приятное чувство отдыха среди тех роскошных условий жизни, к которым он привык с детства. Кроме того ему было приятно после австрийского приема поговорить хоть не по русски (они говорили по французски), но с русским человеком, который, он предполагал, разделял общее русское отвращение (теперь особенно живо испытываемое) к австрийцам.
Билибин был человек лет тридцати пяти, холостой, одного общества с князем Андреем. Они были знакомы еще в Петербурге, но еще ближе познакомились в последний приезд князя Андрея в Вену вместе с Кутузовым. Как князь Андрей был молодой человек, обещающий пойти далеко на военном поприще, так, и еще более, обещал Билибин на дипломатическом. Он был еще молодой человек, но уже немолодой дипломат, так как он начал служить с шестнадцати лет, был в Париже, в Копенгагене и теперь в Вене занимал довольно значительное место. И канцлер и наш посланник в Вене знали его и дорожили им. Он был не из того большого количества дипломатов, которые обязаны иметь только отрицательные достоинства, не делать известных вещей и говорить по французски для того, чтобы быть очень хорошими дипломатами; он был один из тех дипломатов, которые любят и умеют работать, и, несмотря на свою лень, он иногда проводил ночи за письменным столом. Он работал одинаково хорошо, в чем бы ни состояла сущность работы. Его интересовал не вопрос «зачем?», а вопрос «как?». В чем состояло дипломатическое дело, ему было всё равно; но составить искусно, метко и изящно циркуляр, меморандум или донесение – в этом он находил большое удовольствие. Заслуги Билибина ценились, кроме письменных работ, еще и по его искусству обращаться и говорить в высших сферах.
Билибин любил разговор так же, как он любил работу, только тогда, когда разговор мог быть изящно остроумен. В обществе он постоянно выжидал случая сказать что нибудь замечательное и вступал в разговор не иначе, как при этих условиях. Разговор Билибина постоянно пересыпался оригинально остроумными, законченными фразами, имеющими общий интерес.
Эти фразы изготовлялись во внутренней лаборатории Билибина, как будто нарочно, портативного свойства, для того, чтобы ничтожные светские люди удобно могли запоминать их и переносить из гостиных в гостиные. И действительно, les mots de Bilibine se colportaient dans les salons de Vienne, [Отзывы Билибина расходились по венским гостиным] и часто имели влияние на так называемые важные дела.
Худое, истощенное, желтоватое лицо его было всё покрыто крупными морщинами, которые всегда казались так чистоплотно и старательно промыты, как кончики пальцев после бани. Движения этих морщин составляли главную игру его физиономии. То у него морщился лоб широкими складками, брови поднимались кверху, то брови спускались книзу, и у щек образовывались крупные морщины. Глубоко поставленные, небольшие глаза всегда смотрели прямо и весело.
– Ну, теперь расскажите нам ваши подвиги, – сказал он.
Болконский самым скромным образом, ни разу не упоминая о себе, рассказал дело и прием военного министра.
– Ils m'ont recu avec ma nouvelle, comme un chien dans un jeu de quilles, [Они приняли меня с этою вестью, как принимают собаку, когда она мешает игре в кегли,] – заключил он.
Билибин усмехнулся и распустил складки кожи.
– Cependant, mon cher, – сказал он, рассматривая издалека свой ноготь и подбирая кожу над левым глазом, – malgre la haute estime que je professe pour le православное российское воинство, j'avoue que votre victoire n'est pas des plus victorieuses. [Однако, мой милый, при всем моем уважении к православному российскому воинству, я полагаю, что победа ваша не из самых блестящих.]
Он продолжал всё так же на французском языке, произнося по русски только те слова, которые он презрительно хотел подчеркнуть.
– Как же? Вы со всею массой своею обрушились на несчастного Мортье при одной дивизии, и этот Мортье уходит у вас между рук? Где же победа?
– Однако, серьезно говоря, – отвечал князь Андрей, – всё таки мы можем сказать без хвастовства, что это немного получше Ульма…
– Отчего вы не взяли нам одного, хоть одного маршала?
– Оттого, что не всё делается, как предполагается, и не так регулярно, как на параде. Мы полагали, как я вам говорил, зайти в тыл к семи часам утра, а не пришли и к пяти вечера.
– Отчего же вы не пришли к семи часам утра? Вам надо было притти в семь часов утра, – улыбаясь сказал Билибин, – надо было притти в семь часов утра.
– Отчего вы не внушили Бонапарту дипломатическим путем, что ему лучше оставить Геную? – тем же тоном сказал князь Андрей.
– Я знаю, – перебил Билибин, – вы думаете, что очень легко брать маршалов, сидя на диване перед камином. Это правда, а всё таки, зачем вы его не взяли? И не удивляйтесь, что не только военный министр, но и августейший император и король Франц не будут очень осчастливлены вашей победой; да и я, несчастный секретарь русского посольства, не чувствую никакой потребности в знак радости дать моему Францу талер и отпустить его с своей Liebchen [милой] на Пратер… Правда, здесь нет Пратера.
Он посмотрел прямо на князя Андрея и вдруг спустил собранную кожу со лба.
– Теперь мой черед спросить вас «отчего», мой милый, – сказал Болконский. – Я вам признаюсь, что не понимаю, может быть, тут есть дипломатические тонкости выше моего слабого ума, но я не понимаю: Мак теряет целую армию, эрцгерцог Фердинанд и эрцгерцог Карл не дают никаких признаков жизни и делают ошибки за ошибками, наконец, один Кутузов одерживает действительную победу, уничтожает charme [очарование] французов, и военный министр не интересуется даже знать подробности.
– Именно от этого, мой милый. Voyez vous, mon cher: [Видите ли, мой милый:] ура! за царя, за Русь, за веру! Tout ca est bel et bon, [все это прекрасно и хорошо,] но что нам, я говорю – австрийскому двору, за дело до ваших побед? Привезите вы нам свое хорошенькое известие о победе эрцгерцога Карла или Фердинанда – un archiduc vaut l'autre, [один эрцгерцог стоит другого,] как вам известно – хоть над ротой пожарной команды Бонапарте, это другое дело, мы прогремим в пушки. А то это, как нарочно, может только дразнить нас. Эрцгерцог Карл ничего не делает, эрцгерцог Фердинанд покрывается позором. Вену вы бросаете, не защищаете больше, comme si vous nous disiez: [как если бы вы нам сказали:] с нами Бог, а Бог с вами, с вашей столицей. Один генерал, которого мы все любили, Шмит: вы его подводите под пулю и поздравляете нас с победой!… Согласитесь, что раздразнительнее того известия, которое вы привозите, нельзя придумать. C'est comme un fait expres, comme un fait expres. [Это как нарочно, как нарочно.] Кроме того, ну, одержи вы точно блестящую победу, одержи победу даже эрцгерцог Карл, что ж бы это переменило в общем ходе дел? Теперь уж поздно, когда Вена занята французскими войсками.
– Как занята? Вена занята?
– Не только занята, но Бонапарте в Шенбрунне, а граф, наш милый граф Врбна отправляется к нему за приказаниями.
Болконский после усталости и впечатлений путешествия, приема и в особенности после обеда чувствовал, что он не понимает всего значения слов, которые он слышал.
– Нынче утром был здесь граф Лихтенфельс, – продолжал Билибин, – и показывал мне письмо, в котором подробно описан парад французов в Вене. Le prince Murat et tout le tremblement… [Принц Мюрат и все такое…] Вы видите, что ваша победа не очень то радостна, и что вы не можете быть приняты как спаситель…
– Право, для меня всё равно, совершенно всё равно! – сказал князь Андрей, начиная понимать,что известие его о сражении под Кремсом действительно имело мало важности ввиду таких событий, как занятие столицы Австрии. – Как же Вена взята? А мост и знаменитый tete de pont, [мостовое укрепление,] и князь Ауэрсперг? У нас были слухи, что князь Ауэрсперг защищает Вену, – сказал он.
– Князь Ауэрсперг стоит на этой, на нашей, стороне и защищает нас; я думаю, очень плохо защищает, но всё таки защищает. А Вена на той стороне. Нет, мост еще не взят и, надеюсь, не будет взят, потому что он минирован, и его велено взорвать. В противном случае мы были бы давно в горах Богемии, и вы с вашею армией провели бы дурную четверть часа между двух огней.
– Но это всё таки не значит, чтобы кампания была кончена, – сказал князь Андрей.
– А я думаю, что кончена. И так думают большие колпаки здесь, но не смеют сказать этого. Будет то, что я говорил в начале кампании, что не ваша echauffouree de Durenstein, [дюренштейнская стычка,] вообще не порох решит дело, а те, кто его выдумали, – сказал Билибин, повторяя одно из своих mots [словечек], распуская кожу на лбу и приостанавливаясь. – Вопрос только в том, что скажет берлинское свидание императора Александра с прусским королем. Ежели Пруссия вступит в союз, on forcera la main a l'Autriche, [принудят Австрию,] и будет война. Ежели же нет, то дело только в том, чтоб условиться, где составлять первоначальные статьи нового Саmро Formio. [Кампо Формио.]
– Но что за необычайная гениальность! – вдруг вскрикнул князь Андрей, сжимая свою маленькую руку и ударяя ею по столу. – И что за счастие этому человеку!
– Buonaparte? [Буонапарте?] – вопросительно сказал Билибин, морща лоб и этим давая чувствовать, что сейчас будет un mot [словечко]. – Bu onaparte? – сказал он, ударяя особенно на u . – Я думаю, однако, что теперь, когда он предписывает законы Австрии из Шенбрунна, il faut lui faire grace de l'u . [надо его избавить от и.] Я решительно делаю нововведение и называю его Bonaparte tout court [просто Бонапарт].
– Нет, без шуток, – сказал князь Андрей, – неужели вы думаете,что кампания кончена?
– Я вот что думаю. Австрия осталась в дурах, а она к этому не привыкла. И она отплатит. А в дурах она осталась оттого, что, во первых, провинции разорены (on dit, le православное est terrible pour le pillage), [говорят, что православное ужасно по части грабежей,] армия разбита, столица взята, и всё это pour les beaux yeux du [ради прекрасных глаз,] Сардинское величество. И потому – entre nous, mon cher [между нами, мой милый] – я чутьем слышу, что нас обманывают, я чутьем слышу сношения с Францией и проекты мира, тайного мира, отдельно заключенного.
– Это не может быть! – сказал князь Андрей, – это было бы слишком гадко.
– Qui vivra verra, [Поживем, увидим,] – сказал Билибин, распуская опять кожу в знак окончания разговора.
Когда князь Андрей пришел в приготовленную для него комнату и в чистом белье лег на пуховики и душистые гретые подушки, – он почувствовал, что то сражение, о котором он привез известие, было далеко, далеко от него. Прусский союз, измена Австрии, новое торжество Бонапарта, выход и парад, и прием императора Франца на завтра занимали его.
Он закрыл глаза, но в то же мгновение в ушах его затрещала канонада, пальба, стук колес экипажа, и вот опять спускаются с горы растянутые ниткой мушкатеры, и французы стреляют, и он чувствует, как содрогается его сердце, и он выезжает вперед рядом с Шмитом, и пули весело свистят вокруг него, и он испытывает то чувство удесятеренной радости жизни, какого он не испытывал с самого детства.
Он пробудился…
«Да, всё это было!…» сказал он, счастливо, детски улыбаясь сам себе, и заснул крепким, молодым сном.
На другой день он проснулся поздно. Возобновляя впечатления прошедшего, он вспомнил прежде всего то, что нынче надо представляться императору Францу, вспомнил военного министра, учтивого австрийского флигель адъютанта, Билибина и разговор вчерашнего вечера. Одевшись в полную парадную форму, которой он уже давно не надевал, для поездки во дворец, он, свежий, оживленный и красивый, с подвязанною рукой, вошел в кабинет Билибина. В кабинете находились четыре господина дипломатического корпуса. С князем Ипполитом Курагиным, который был секретарем посольства, Болконский был знаком; с другими его познакомил Билибин.
Господа, бывавшие у Билибина, светские, молодые, богатые и веселые люди, составляли и в Вене и здесь отдельный кружок, который Билибин, бывший главой этого кружка, называл наши, les nфtres. В кружке этом, состоявшем почти исключительно из дипломатов, видимо, были свои, не имеющие ничего общего с войной и политикой, интересы высшего света, отношений к некоторым женщинам и канцелярской стороны службы. Эти господа, повидимому, охотно, как своего (честь, которую они делали немногим), приняли в свой кружок князя Андрея. Из учтивости, и как предмет для вступления в разговор, ему сделали несколько вопросов об армии и сражении, и разговор опять рассыпался на непоследовательные, веселые шутки и пересуды.
– Но особенно хорошо, – говорил один, рассказывая неудачу товарища дипломата, – особенно хорошо то, что канцлер прямо сказал ему, что назначение его в Лондон есть повышение, и чтоб он так и смотрел на это. Видите вы его фигуру при этом?…
– Но что всего хуже, господа, я вам выдаю Курагина: человек в несчастии, и этим то пользуется этот Дон Жуан, этот ужасный человек!
Князь Ипполит лежал в вольтеровском кресле, положив ноги через ручку. Он засмеялся.
– Parlez moi de ca, [Ну ка, ну ка,] – сказал он.
– О, Дон Жуан! О, змея! – послышались голоса.
– Вы не знаете, Болконский, – обратился Билибин к князю Андрею, – что все ужасы французской армии (я чуть было не сказал – русской армии) – ничто в сравнении с тем, что наделал между женщинами этот человек.
– La femme est la compagne de l'homme, [Женщина – подруга мужчины,] – произнес князь Ипполит и стал смотреть в лорнет на свои поднятые ноги.
Билибин и наши расхохотались, глядя в глаза Ипполиту. Князь Андрей видел, что этот Ипполит, которого он (должно было признаться) почти ревновал к своей жене, был шутом в этом обществе.
– Нет, я должен вас угостить Курагиным, – сказал Билибин тихо Болконскому. – Он прелестен, когда рассуждает о политике, надо видеть эту важность.
Он подсел к Ипполиту и, собрав на лбу свои складки, завел с ним разговор о политике. Князь Андрей и другие обступили обоих.
– Le cabinet de Berlin ne peut pas exprimer un sentiment d'alliance, – начал Ипполит, значительно оглядывая всех, – sans exprimer… comme dans sa derieniere note… vous comprenez… vous comprenez… et puis si sa Majeste l'Empereur ne deroge pas au principe de notre alliance… [Берлинский кабинет не может выразить свое мнение о союзе, не выражая… как в своей последней ноте… вы понимаете… вы понимаете… впрочем, если его величество император не изменит сущности нашего союза…]
– Attendez, je n'ai pas fini… – сказал он князю Андрею, хватая его за руку. – Je suppose que l'intervention sera plus forte que la non intervention. Et… – Он помолчал. – On ne pourra pas imputer a la fin de non recevoir notre depeche du 28 novembre. Voila comment tout cela finira. [Подождите, я не кончил. Я думаю, что вмешательство будет прочнее чем невмешательство И… Невозможно считать дело оконченным непринятием нашей депеши от 28 ноября. Чем то всё это кончится.]
И он отпустил руку Болконского, показывая тем, что теперь он совсем кончил.
– Demosthenes, je te reconnais au caillou que tu as cache dans ta bouche d'or! [Демосфен, я узнаю тебя по камешку, который ты скрываешь в своих золотых устах!] – сказал Билибин, y которого шапка волос подвинулась на голове от удовольствия.
Все засмеялись. Ипполит смеялся громче всех. Он, видимо, страдал, задыхался, но не мог удержаться от дикого смеха, растягивающего его всегда неподвижное лицо.
– Ну вот что, господа, – сказал Билибин, – Болконский мой гость в доме и здесь в Брюнне, и я хочу его угостить, сколько могу, всеми радостями здешней жизни. Ежели бы мы были в Брюнне, это было бы легко; но здесь, dans ce vilain trou morave [в этой скверной моравской дыре], это труднее, и я прошу у всех вас помощи. Il faut lui faire les honneurs de Brunn. [Надо ему показать Брюнн.] Вы возьмите на себя театр, я – общество, вы, Ипполит, разумеется, – женщин.
– Надо ему показать Амели, прелесть! – сказал один из наших, целуя кончики пальцев.
– Вообще этого кровожадного солдата, – сказал Билибин, – надо обратить к более человеколюбивым взглядам.
– Едва ли я воспользуюсь вашим гостеприимством, господа, и теперь мне пора ехать, – взглядывая на часы, сказал Болконский.
– Куда?
– К императору.
– О! о! о!
– Ну, до свидания, Болконский! До свидания, князь; приезжайте же обедать раньше, – пocлшaлиcь голоса. – Мы беремся за вас.
– Старайтесь как можно более расхваливать порядок в доставлении провианта и маршрутов, когда будете говорить с императором, – сказал Билибин, провожая до передней Болконского.
– И желал бы хвалить, но не могу, сколько знаю, – улыбаясь отвечал Болконский.
– Ну, вообще как можно больше говорите. Его страсть – аудиенции; а говорить сам он не любит и не умеет, как увидите.
На выходе император Франц только пристально вгляделся в лицо князя Андрея, стоявшего в назначенном месте между австрийскими офицерами, и кивнул ему своей длинной головой. Но после выхода вчерашний флигель адъютант с учтивостью передал Болконскому желание императора дать ему аудиенцию.
Император Франц принял его, стоя посредине комнаты. Перед тем как начинать разговор, князя Андрея поразило то, что император как будто смешался, не зная, что сказать, и покраснел.
– Скажите, когда началось сражение? – спросил он поспешно.
Князь Андрей отвечал. После этого вопроса следовали другие, столь же простые вопросы: «здоров ли Кутузов? как давно выехал он из Кремса?» и т. п. Император говорил с таким выражением, как будто вся цель его состояла только в том, чтобы сделать известное количество вопросов. Ответы же на эти вопросы, как было слишком очевидно, не могли интересовать его.
– В котором часу началось сражение? – спросил император.
– Не могу донести вашему величеству, в котором часу началось сражение с фронта, но в Дюренштейне, где я находился, войско начало атаку в 6 часу вечера, – сказал Болконский, оживляясь и при этом случае предполагая, что ему удастся представить уже готовое в его голове правдивое описание всего того, что он знал и видел.
Но император улыбнулся и перебил его:
– Сколько миль?
– Откуда и докуда, ваше величество?
– От Дюренштейна до Кремса?
– Три с половиною мили, ваше величество.
– Французы оставили левый берег?
– Как доносили лазутчики, в ночь на плотах переправились последние.
– Достаточно ли фуража в Кремсе?
– Фураж не был доставлен в том количестве…
Император перебил его.
– В котором часу убит генерал Шмит?…
– В семь часов, кажется.
– В 7 часов. Очень печально! Очень печально!
Император сказал, что он благодарит, и поклонился. Князь Андрей вышел и тотчас же со всех сторон был окружен придворными. Со всех сторон глядели на него ласковые глаза и слышались ласковые слова. Вчерашний флигель адъютант делал ему упреки, зачем он не остановился во дворце, и предлагал ему свой дом. Военный министр подошел, поздравляя его с орденом Марии Терезии З й степени, которым жаловал его император. Камергер императрицы приглашал его к ее величеству. Эрцгерцогиня тоже желала его видеть. Он не знал, кому отвечать, и несколько секунд собирался с мыслями. Русский посланник взял его за плечо, отвел к окну и стал говорить с ним.
