Протеасома

 Протеасо́ма (от англ. protease — протеиназа и лат. soma — тело) — очень крупная мультисубъединичная протеаза, присутствующая в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме[1]. Основная функция протеасомы — протеолитическая деградация ненужных и повреждённых белков до коротких пептидов (4—25 аминокислотных остатков), которые затем могут быть расщеплены до отдельных аминокислот[2][3]. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы[3]. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени[2][3]. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Протеасо́ма (от англ. protease — протеиназа и лат. soma — тело) — очень крупная мультисубъединичная протеаза, присутствующая в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме[1]. Основная функция протеасомы — протеолитическая деградация ненужных и повреждённых белков до коротких пептидов (4—25 аминокислотных остатков), которые затем могут быть расщеплены до отдельных аминокислот[2][3]. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы[3]. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени[2][3]. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Протеасомальная деградация белка важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс. В 2004 году Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-зависимой деградации белка»[4].
История открытия
До открытия убиквитин-зависимой системы деградации белков считалось, что деградация белков в клетке происходит, главным образом, за счёт лизосом. Лизосомы — это мембранные органоиды с кислой внутренней средой, содержащей протеазы. Они способны утилизировать экзогенные белки, захваченные клеткой в процессе эндоцитоза, белки, связанные с мембранами, и повреждённые органеллы[2][3]. Однако в 1977 году Алфред Голдберг доказал существование АТФ-зависимой системы деградации белка в ретикулоцитах, которые лишены лизосом[5]. Это позволило предположить, что существует, как минимум, ещё один механизм внутриклеточного расщепления белка. В 1978 году было показано, что соответствующая протеаза состоит из полипептидных цепей нескольких типов[6]. Позднее при исследовании посттрансляционных модификаций гистонов была обнаружена неожиданная ковалентная модификация: присоединение к боковой цепи остатка лизина в гистоне C-концевого остатка глицина убиквитина — небольшого белка с неизвестной функцией[7]. В дальнейшем было установлено, что описанный ранее ATP-dependent proteolysis factor 1 (APF-1) и убиквитин являются одним и тем же белком[8]. Позднее АТФ-зависимый белковый комплекс, ответственный за убиквитин-опосредованную деградацию белка, был выделен из лизата клеток и назван 26S-протеасомой[9][10].
Большая часть ранних работ, которые впоследствии привели к открытию протеасомальной системы деградации белков, была выполнена в конце 1970-х — начале 1980-х годов в лаборатории Аврама Хершко в Технионе, где Аарон Чехановер был аспирантом. Ключевые концептуальные идеи Хершко выработал за год работы в лаборатории Ирвина Роуза, хотя Роуз впоследствии и приуменьшал свою роль в открытии[11]. Все трое разделили Нобелевскую премию по химии в 2004 году за открытие этой системы.
Хотя электронно-микроскопические данные, указывающие на то, что структура протеасомы представляет собой несколько колец, уложенных в стопку, были доступны уже в середине 1980-х годов[12], первая структура коровой части протеасомы, составленная на основе данных рентгеноструктурного анализа, была получена только в 1994 году[13].
Структура

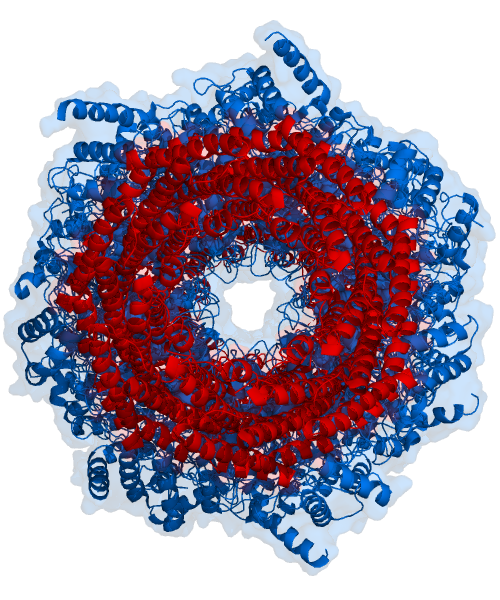
 Компоненты протеасомы часто называются в соответствии с их коэффициентами седиментации в сведбергах (обозначается буквой S). Протеасома, активная в расщеплении белков, называется 26S-протеасомой и обычно состоит из коровой 20S-протеасомы и одной или двух регуляторных частиц 19S (PA700), которые присоединяются к торцам коровой частицы. Хотя присоединение двух регуляторных частиц, строго говоря, приводит к формированию протеасомы с коэффициентом седиментации 30S, термин «30S-протеасома» в литературе практически не используется, а название «26S-протеасома» применяется по отношению к обеим изоформам. Кроме регуляторной частицы 19S, в состав 26S-протеасомы могут входить и другие регуляторные компоненты: PA28α/β (11S REG), PA28γ (REGγ), PA200, PI31[3].
Компоненты протеасомы часто называются в соответствии с их коэффициентами седиментации в сведбергах (обозначается буквой S). Протеасома, активная в расщеплении белков, называется 26S-протеасомой и обычно состоит из коровой 20S-протеасомы и одной или двух регуляторных частиц 19S (PA700), которые присоединяются к торцам коровой частицы. Хотя присоединение двух регуляторных частиц, строго говоря, приводит к формированию протеасомы с коэффициентом седиментации 30S, термин «30S-протеасома» в литературе практически не используется, а название «26S-протеасома» применяется по отношению к обеим изоформам. Кроме регуляторной частицы 19S, в состав 26S-протеасомы могут входить и другие регуляторные компоненты: PA28α/β (11S REG), PA28γ (REGγ), PA200, PI31[3].
20S-протеасома
20S-протеасомы прокариот и эукариот имеют принципиально одинаковую четвертичную структуру и состоят из 28 субъединиц, организованных в четыре 7-членных кольца, уложенных друг на друга в виде стопки[3]. Однако разнообразие субчастиц протеасомы зависит от конкретного организма: разнообразие субъединиц выше у многоклеточных организмов по сравнению с одноклеточными и у эукариот по сравнению с прокариотами. Протеасомы прокариот состоят из 14 копий идентичных α-субъединиц, которые формируют внешние кольца, и 14 копий идентичных β-субъединиц, которые формируют внутренние кольца. В эукариотической протеасоме все семь субъединиц одного кольца отличаются по структуре, то есть протеасома состоит из двух копий семи разных α-субъединиц и двух копий семи разных β-субъединиц. Несмотря на небольшие различия, с точки зрения пространственной структуры α- и β-субъединицы тем не менее очень похожи.
α-субъединицы отвечают за присоединение к 20S-протеасоме регуляторных частиц, а их N-концевые участки прикрывают вход в полость протеасомы, что исключает неконтролируемый протеолиз[14]. β-субъединицы имеют протеазные центры и являются каталитическими компонентами протеасомы. У архей, например у Thermoplasma acidophilum, все β-субъединицы одинаковы, поэтому протеасома содержит 14 идентичных протеазных центров. В протеасомах млекопитающих каталитически активными являются только β1-, β2- и β5-субъединицы, причём все эти субъединицы обладают разными субстратными специфичностями (каспазоподобной, трипсиноподобной и химотрипсиноподобной соответственно)[15].
Размеры протеасом относительно эволюционно стабильны и составляют 150 на 115 ангстрем. Внутренняя полость имеет максимальную ширину 53 ангстрема, однако вход в протеасому может иметь ширину всего 13 ангстрем, это указывает на то, что для входа в протеасому белок должен быть хотя бы частично денатурирован[16].
Функции
Протеасомы обеспечивают убиквитин-зависимую деградацию белков цитоплазмы и нуклеоплазмы. В частности, в протеасомах разрушаются метаболические ферменты (короткоживущие из-за регуляторной функции), реплицирующие ДНК белки (нужны только на период S-фазы клеточного цикла), гемоглобин, структурные белки и др.
Ингибиторы
Напишите отзыв о статье "Протеасома"
Ссылки
- ↑ Peters JM, Franke WW, Kleinschmidt JA. (1994) Distinct 19S and 20S subcomplexes of the 26S proteasome and their distribution in the nucleus and the cytoplasm. J Biol Chem, March 11;269(10):7709-18. PMID 8125997
- ↑ 1 2 3 Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. 3 // Molecular cell biology. — 5th. — New York: W.H. Freeman and CO, 2004. — P. 66–72. — ISBN 0-7167-4366-3.
- ↑ 1 2 3 4 5 6 Сорокин А. В., Ким Е. Р., Овчинников Л. П. (2009). «Протеасомная система деградации и процессинга белков». Успехи биологической химии 49: 3—76.
- ↑ Nobel Prize Committee. [nobelprize.org/nobel_prizes/chemistry/laureates/2004/ Nobel Prize Awardees in Chemistry, 2004] (2004). Проверено 11 декабря 2006. [www.webcitation.org/68Cana11X Архивировано из первоисточника 6 июня 2012].
- ↑ Etlinger JD, Goldberg AL. (January 1977). «A soluble ATP-dependent proteolytic system responsible for the degradation of abnormal proteins in reticulocytes». PNAS 74 (1): 54–8. DOI:10.1073/pnas.74.1.54. PMID 264694.
- ↑ Ciehanover A, Hod Y, Hershko A. (1978). «A heat-stable polypeptide component of an ATP-dependent proteolytic system from reticulocytes». Biochemical and Biophysical Research Communications 81 (4): 1100–5. DOI:10.1016/0006-291X(78)91249-4. PMID 666810.
- ↑ Goldknopf IL, Busch H. (1977). «Isopeptide linkage between nonhistone and histone 2A polypeptides of chromosomal conjugate-protein A24». PNAS 74 (3): 864–8. DOI:10.1073/pnas.74.3.864. PMID 265581.
- ↑ Ciechanover A. (2000). «Early work on the ubiquitin proteasome system, an interview with Aaron Ciechanover». Cell Death and Differentiation 12 (9): 1167–77. DOI:10.1038/sj.cdd.4401691. PMID 16094393.
- ↑ Tanaka K, Waxman L, Goldberg AL. (June 1983). «ATP serves two distinct roles in protein degradation in reticulocytes, one requiring and one independent of ubiquitin». The Journal of Cell Biology 96 (6): 1580–5. DOI:10.1083/jcb.96.6.1580. PMID 6304111.
- ↑ Hough R, Pratt G, Rechsteiner M. (June 1987). «[www.jbc.org/cgi/pmidlookup?view=long&pmid=3298229 Purification of two high molecular weight proteases from rabbit reticulocyte lysate]». The Journal of Biological Chemistry 262 (17): 8303–13. PMID 3298229.
- ↑ Hershko A (2005). «Early work on the ubiquitin proteasome system, an interview with Avram Hershko». Cell Death Differ 12 (9): 1158–1161. DOI:10.1038/sj.cdd.4401709. PMID 16094391.
- ↑ Kopp F et al. (1986). «Size and shape of the multicatalytic proteinase from rat skeletal muscle». Biochim Biophys Acta 872 (3): 253–60. DOI:10.1016/0167-4838(86)90278-5. PMID 3524688.
- ↑ Löwe J et al. (1995). «Crystal structure of the 20S proteasome from the archaeon T. acidophilum at 3.4 Å resolution». Science 268 (5210): 533–539. DOI:10.1126/science.7725097. PMID 7725097.
- ↑ Smith DM, Chang SC, Park S, Finley D, Cheng Y, Goldberg AL (September 2007). «Docking of the proteasomal ATPases' carboxyl termini in the 20S proteasome's alpha ring opens the gate for substrate entry». Mol. Cell 27 (5): 731–44. DOI:10.1016/j.molcel.2007.06.033. PMID 17803938.
- ↑ Heinemeyer W et al. (1997). «The active sites of the eukaryotic 20 S proteasome and their involvement in subunit precursor processing». J Biol Chem 272 (40): 25200–9. DOI:10.1074/jbc.272.40.25200. PMID 9312134.
- ↑ Nandi D et al. (2006). «The ubiquitin-proteasome system». J Biosci 31 (1): 137–55. DOI:10.1007/BF02705243. PMID 16595883.
| ||||||||||||||||||||||
Отрывок, характеризующий Протеасома
Так он лежал и теперь на своей кровати, облокотив тяжелую, большую изуродованную голову на пухлую руку, и думал, открытым одним глазом присматриваясь к темноте.С тех пор как Бенигсен, переписывавшийся с государем и имевший более всех силы в штабе, избегал его, Кутузов был спокойнее в том отношении, что его с войсками не заставят опять участвовать в бесполезных наступательных действиях. Урок Тарутинского сражения и кануна его, болезненно памятный Кутузову, тоже должен был подействовать, думал он.
«Они должны понять, что мы только можем проиграть, действуя наступательно. Терпение и время, вот мои воины богатыри!» – думал Кутузов. Он знал, что не надо срывать яблоко, пока оно зелено. Оно само упадет, когда будет зрело, а сорвешь зелено, испортишь яблоко и дерево, и сам оскомину набьешь. Он, как опытный охотник, знал, что зверь ранен, ранен так, как только могла ранить вся русская сила, но смертельно или нет, это был еще не разъясненный вопрос. Теперь, по присылкам Лористона и Бертелеми и по донесениям партизанов, Кутузов почти знал, что он ранен смертельно. Но нужны были еще доказательства, надо было ждать.
«Им хочется бежать посмотреть, как они его убили. Подождите, увидите. Все маневры, все наступления! – думал он. – К чему? Все отличиться. Точно что то веселое есть в том, чтобы драться. Они точно дети, от которых не добьешься толку, как было дело, оттого что все хотят доказать, как они умеют драться. Да не в том теперь дело.
И какие искусные маневры предлагают мне все эти! Им кажется, что, когда они выдумали две три случайности (он вспомнил об общем плане из Петербурга), они выдумали их все. А им всем нет числа!»
Неразрешенный вопрос о том, смертельна или не смертельна ли была рана, нанесенная в Бородине, уже целый месяц висел над головой Кутузова. С одной стороны, французы заняли Москву. С другой стороны, несомненно всем существом своим Кутузов чувствовал, что тот страшный удар, в котором он вместе со всеми русскими людьми напряг все свои силы, должен был быть смертелен. Но во всяком случае нужны были доказательства, и он ждал их уже месяц, и чем дальше проходило время, тем нетерпеливее он становился. Лежа на своей постели в свои бессонные ночи, он делал то самое, что делала эта молодежь генералов, то самое, за что он упрекал их. Он придумывал все возможные случайности, в которых выразится эта верная, уже свершившаяся погибель Наполеона. Он придумывал эти случайности так же, как и молодежь, но только с той разницей, что он ничего не основывал на этих предположениях и что он видел их не две и три, а тысячи. Чем дальше он думал, тем больше их представлялось. Он придумывал всякого рода движения наполеоновской армии, всей или частей ее – к Петербургу, на него, в обход его, придумывал (чего он больше всего боялся) и ту случайность, что Наполеон станет бороться против него его же оружием, что он останется в Москве, выжидая его. Кутузов придумывал даже движение наполеоновской армии назад на Медынь и Юхнов, но одного, чего он не мог предвидеть, это того, что совершилось, того безумного, судорожного метания войска Наполеона в продолжение первых одиннадцати дней его выступления из Москвы, – метания, которое сделало возможным то, о чем все таки не смел еще тогда думать Кутузов: совершенное истребление французов. Донесения Дорохова о дивизии Брусье, известия от партизанов о бедствиях армии Наполеона, слухи о сборах к выступлению из Москвы – все подтверждало предположение, что французская армия разбита и сбирается бежать; но это были только предположения, казавшиеся важными для молодежи, но не для Кутузова. Он с своей шестидесятилетней опытностью знал, какой вес надо приписывать слухам, знал, как способны люди, желающие чего нибудь, группировать все известия так, что они как будто подтверждают желаемое, и знал, как в этом случае охотно упускают все противоречащее. И чем больше желал этого Кутузов, тем меньше он позволял себе этому верить. Вопрос этот занимал все его душевные силы. Все остальное было для него только привычным исполнением жизни. Таким привычным исполнением и подчинением жизни были его разговоры с штабными, письма к m me Stael, которые он писал из Тарутина, чтение романов, раздачи наград, переписка с Петербургом и т. п. Но погибель французов, предвиденная им одним, было его душевное, единственное желание.
В ночь 11 го октября он лежал, облокотившись на руку, и думал об этом.
В соседней комнате зашевелилось, и послышались шаги Толя, Коновницына и Болховитинова.
– Эй, кто там? Войдите, войди! Что новенького? – окликнул их фельдмаршал.
Пока лакей зажигал свечу, Толь рассказывал содержание известий.
– Кто привез? – спросил Кутузов с лицом, поразившим Толя, когда загорелась свеча, своей холодной строгостью.
– Не может быть сомнения, ваша светлость.
– Позови, позови его сюда!
Кутузов сидел, спустив одну ногу с кровати и навалившись большим животом на другую, согнутую ногу. Он щурил свой зрячий глаз, чтобы лучше рассмотреть посланного, как будто в его чертах он хотел прочесть то, что занимало его.
– Скажи, скажи, дружок, – сказал он Болховитинову своим тихим, старческим голосом, закрывая распахнувшуюся на груди рубашку. – Подойди, подойди поближе. Какие ты привез мне весточки? А? Наполеон из Москвы ушел? Воистину так? А?
Болховитинов подробно доносил сначала все то, что ему было приказано.
– Говори, говори скорее, не томи душу, – перебил его Кутузов.
Болховитинов рассказал все и замолчал, ожидая приказания. Толь начал было говорить что то, но Кутузов перебил его. Он хотел сказать что то, но вдруг лицо его сщурилось, сморщилось; он, махнув рукой на Толя, повернулся в противную сторону, к красному углу избы, черневшему от образов.
– Господи, создатель мой! Внял ты молитве нашей… – дрожащим голосом сказал он, сложив руки. – Спасена Россия. Благодарю тебя, господи! – И он заплакал.
Со времени этого известия и до конца кампании вся деятельность Кутузова заключается только в том, чтобы властью, хитростью, просьбами удерживать свои войска от бесполезных наступлений, маневров и столкновений с гибнущим врагом. Дохтуров идет к Малоярославцу, но Кутузов медлит со всей армией и отдает приказания об очищении Калуги, отступление за которую представляется ему весьма возможным.
Кутузов везде отступает, но неприятель, не дожидаясь его отступления, бежит назад, в противную сторону.
Историки Наполеона описывают нам искусный маневр его на Тарутино и Малоярославец и делают предположения о том, что бы было, если бы Наполеон успел проникнуть в богатые полуденные губернии.
Но не говоря о том, что ничто не мешало Наполеону идти в эти полуденные губернии (так как русская армия давала ему дорогу), историки забывают то, что армия Наполеона не могла быть спасена ничем, потому что она в самой себе несла уже тогда неизбежные условия гибели. Почему эта армия, нашедшая обильное продовольствие в Москве и не могшая удержать его, а стоптавшая его под ногами, эта армия, которая, придя в Смоленск, не разбирала продовольствия, а грабила его, почему эта армия могла бы поправиться в Калужской губернии, населенной теми же русскими, как и в Москве, и с тем же свойством огня сжигать то, что зажигают?
Армия не могла нигде поправиться. Она, с Бородинского сражения и грабежа Москвы, несла в себе уже как бы химические условия разложения.
Люди этой бывшей армии бежали с своими предводителями сами не зная куда, желая (Наполеон и каждый солдат) только одного: выпутаться лично как можно скорее из того безвыходного положения, которое, хотя и неясно, они все сознавали.
Только поэтому, на совете в Малоярославце, когда, притворяясь, что они, генералы, совещаются, подавая разные мнения, последнее мнение простодушного солдата Мутона, сказавшего то, что все думали, что надо только уйти как можно скорее, закрыло все рты, и никто, даже Наполеон, не мог сказать ничего против этой всеми сознаваемой истины.
Но хотя все и знали, что надо было уйти, оставался еще стыд сознания того, что надо бежать. И нужен был внешний толчок, который победил бы этот стыд. И толчок этот явился в нужное время. Это было так называемое у французов le Hourra de l'Empereur [императорское ура].
На другой день после совета Наполеон, рано утром, притворяясь, что хочет осматривать войска и поле прошедшего и будущего сражения, с свитой маршалов и конвоя ехал по середине линии расположения войск. Казаки, шнырявшие около добычи, наткнулись на самого императора и чуть чуть не поймали его. Ежели казаки не поймали в этот раз Наполеона, то спасло его то же, что губило французов: добыча, на которую и в Тарутине и здесь, оставляя людей, бросались казаки. Они, не обращая внимания на Наполеона, бросились на добычу, и Наполеон успел уйти.
Когда вот вот les enfants du Don [сыны Дона] могли поймать самого императора в середине его армии, ясно было, что нечего больше делать, как только бежать как можно скорее по ближайшей знакомой дороге. Наполеон, с своим сорокалетним брюшком, не чувствуя в себе уже прежней поворотливости и смелости, понял этот намек. И под влиянием страха, которого он набрался от казаков, тотчас же согласился с Мутоном и отдал, как говорят историки, приказание об отступлении назад на Смоленскую дорогу.
То, что Наполеон согласился с Мутоном и что войска пошли назад, не доказывает того, что он приказал это, но что силы, действовавшие на всю армию, в смысле направления ее по Можайской дороге, одновременно действовали и на Наполеона.
Когда человек находится в движении, он всегда придумывает себе цель этого движения. Для того чтобы идти тысячу верст, человеку необходимо думать, что что то хорошее есть за этими тысячью верст. Нужно представление об обетованной земле для того, чтобы иметь силы двигаться.
