Никотинамидадениндинуклеотид
Никотинамидадениндинуклеотид
| |
|---|---|
NAD+ phys.svg | |
NAD-2FM3-3D-sticks.png | |
Общие
| |
| Хим. формула | C21H27N7O14P2 |
Физические свойства
| |
| Состояние | белый порошок |
| Молярная масса | 663,43 г/моль |
Термические свойства
| |
| Т. плав. | 160 ℃ |
Химические свойства
| |
| Растворимость в воде | 1 г/100 мл |
Классификация
| |
| Номер CAS | |
C1=CC(=C[N+](=C1)C2 C(C(C(O2)COP(=O)([O-])OP(=O) (O)OCC3C(C(C(O3)N4C=NC5=C 4N=CN=C5N)O)O)O)O)C(=O)N
| |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Никотинамидадениндинуклеоти́д (англ. Nicotinamide adenine dinucleotide, сокр. NAD, НАД, устар. diphosphopyridine nucleotide, DPN, ДПН) — кофермент, имеющийся во всех живых клетках. NAD представляет собой динуклеотид и состоит из двух нуклеотидов, соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин, другой — никотинамид. Никотинамидадениндинуклеотид существует в двух формах: окисленной (NAD+, NADox) и восстановленной (NADH, NADred).
В метаболизме NAD задействован в окислительно-восстановительных реакциях, перенося электроны из одной реакции в другую. Таким образом, в клетках NAD находится в двух функциональных состояниях: его окисленная форма, NAD+, является окислителем и забирает электроны от другой молекулы, восстанавливаясь в NADH, который далее служит восстановителем и отдаёт электроны. Такие реакции, сопряжённые с переносом электронов, являются основной сферой действия NAD. Однако NAD имеет и другие функции в клетке, в частности, он служит субстратом для ферментов, удаляющих или присоединяющих химические группы к белкам в ходе посттрансляционных модификаций. Из-за важности функций NAD, ферменты, участвующие в его метаболизме, являются мишенями для поиска новых препаратов[en].
В живых организмах NAD синтезируется de novo[en] из аминокислот аспартата или триптофана. Другие предшественники кофермента поступают в организм экзогенно, как, например, витамин ниацин (витамин В3) с пищей. Похожие соединения образуются в реакциях, приводящих к распаду NAD. После этого такие соединения проходят путь реутилизации, который возвращает их в активную форму. Некоторые молекулы NAD превращаются в никотинамидадениндинуклеотидфосфат (NADP). Этот близкий к NAD кофермент химически схож с ним, однако в метаболизме они выполняют разные функции.
Хотя NAD+ записывается с плюсом из-за формального положительного заряда атома азота, при физиологических значениях pH большая часть NAD+ на самом деле является анионом с отрицательным зарядом −1, а NADH — анионом с зарядом −2.
NAD называют «V-фактором», необходимым для роста гемофильной палочки (Haemophilus influenzae)[1].
Содержание
Физические и химические свойства
Никотинамидадениндинуклеотид состоит из двух нуклеотидов, соединённых мостиком из двух фосфатных групп, каждая из которых принадлежит одному из этих нуклеотидов. Кроме фосфатов, в состав этих нуклеотидов входит рибоза и азотистое основание, у одного нуклеотида оно представлено аденином, у другого — никотинамидом. Фосфаты прикрепляются к пятым атомам углерода (5′-положение), а азотистые основания — к первым (1′-положение). Никотинамид может присоединяться к аномерному 1′-атому в двух различных ориентациях, в связи с чем NAD существует в виде двух различных диастереомеров. В живых организмах встречается β-никотинамидный диастереомер NAD+[2].
В метаболических процессах NAD участвует в окислительно-восстановительных реакциях, принимая или отдавая электроны[3]. Такие реакции, общее уравнение которых приводится ниже, включают формальную передачу гидрид-иона от исходного вещества (субстрата, RН2) к молекуле NAD+. При этом происходит нуклеофильное присоединение гидрида к никотинамидному фрагменту. Таким образом, исходное соединение RН2 окисляется до R, а NAD+ восстанавливается до NADH.
- RH2 + NAD+ → NADH + H+ + R.
Из электронной пары гидридного иона один электрон переносится на положительно заряженный азот в никотинамидном фрагменте, а атом водорода, оставшийся после отрыва электрона от гидридного иона, переносится на четвёртый атом углерода в кольце (С4), располагающийся напротив атома азота. Стандартный электродный потенциал окислительно-восстановительной пары NAD+/NADH составляет −0,32 вольт, что делает NADH сильным восстановителем[4]. Представленная выше реакция легко обратима, при этом NADH восстанавливает другую молекулу, а сам окисляется до NAD+. Поэтому кофермент может длительно циклично переходить из окисленного состояния в восстановленное, и наоборот, при этом расходования кофермента не происходит[2].
Физически обе формы кофермента представляют собой белый аморфный гигроскопичный порошок, хорошо растворимый в воде[5]. В твёрдом состоянии кофермент сохраняет стабильность в сухих условиях и в темноте. Раствор NAD+ бесцветен и сохраняет стабильность в течение недели при 4 °C и нейтральном pH, однако в щелочах и кислотах он быстро разрушается. При разложении NAD+ образуются продукты, являющиеся ингибиторами ферментов[6].
И NAD+, и NADH устойчиво поглощают ультрафиолетовое излучение из-за наличия аденина. Например, пик поглощения у NAD+ приходится на длину волны 259 нм, а коэффициент экстинкции составляет 16900 М−1см−1. NADH поглощает и волны больших длин, его второй пик поглощения ультрафиолета соответствует длине волны 339 нм, а коэффициент экстинкции равен 6200 М−1см−1[7]. Это различие в спектрах поглощения между окисленной и восстановленной формами кофермента позволяет простым образом измерить переход одной формы в другую при составлении характеристики активности фермента[en] путём измерения поглощения ультрафиолета при 340 нм с помощью спектрофотометра[7].
NAD+ и NADH флуоресцируют по-разному. В растворе NADH имеет пик эмиссии при 460 нм и продолжительность высвечивания 0,4 наносекунд, в то время как окисленная форма кофермента не флуоресцирует[8]. Параметры флуоресцирования NADH изменяются при связывании его с белками, поэтому эти изменения могут быть использованы для измерения константы диссоциации, которая широко используется при изучении кинетики ферментов[en][8][9]. Эти изменения во флуоресценции также могут применяться для оценки изменений в окислительно-восстановительном состоянии клетки методами флуоресцентной микроскопии[10].
Концентрация и положение в клетках
В печени крысы суммарное количество NAD+ и NADH составляет приблизительно 1 мкмоль на грамм сырого веса, что в 10 раз больше концентрации NADP+ и NADPH в этих же клетках[11]. Реальную концентрацию NAD+ в цитозоле измерить сложнее, и, согласно современным представлениям, в клетках животных она составляет 0,3 мМ[12][13], а в клетках дрожжей приблизительно 1,0—2,0 мМ[14]. Однако более 80 % NADH, флуоресцирующего в митохондриях, находится в связанном виде, поэтому его концентрация в растворе значительно ниже[15].
Данные для других компартментов ограничены, хотя известно, что концентрация NAD+ в митохондриях схожа с таковой в цитозоле[13]. В митохондрию NAD+ из цитозоля проникает по специальным мембранным белкам-переносчикам[en], так как кофермент не может диффундировать сквозь мембраны[16].
Баланс между окисленной и восстановленной формой никотинамидадениндинуклеотида называется NAD+/NADH-отношением. Это отношение является важной частью т. н. окислительно-восстановительного состояния клетки — мерой и метаболической активности, и здоровья клетки[17]. Отношение NAD+/NADH имеет комплексное действие и оказывает влияние на активность ряда важнейших ферментов, среди которых глицеральдегид-3-фосфатдегидрогеназа[en] и пируватдегидрогеназный комплекс. В здоровых тканях млекопитающих отношение свободных NAD+ к NADH в цитоплазме обычно приблизительно равно 700; такое значение хорошо подходит для реакций окисления[18][19]. Общее отношение NAD+/NADH значительно ниже и составляет от 3 до 10 у млекопитающих[20]. В то же время отношение NADP+/NADPH в норме составляет около 0,005, то есть NADPH является преобладающей формой этого кофермента[21]. Различие в отношениях NAD+/NADH и NADP+/NADPH лежит в основе различных метаболических ролей NAD и NADP.
Биосинтез
NAD+ синтезируется de novo из аминокислот, а также образуется путём реутилизации продуктов распада пиридиновых нуклеотидов.
Образование de novo
Большинство организмов синтезируют NAD+ из аминокислот[3]. Конкретный набор реакций отличается у различных организмов, однако для всех путей синтеза NAD+ характерно образование хинолината[en] (QA) из аспартата (многие бактерии и растения) либо триптофана (животные и некоторые бактерии)[22][23]. Хинолинат декарбоксилируется и фосфорибозилируется фосфорибозилпирофосфатом в никотинат-рибонуклеотид (NaMN). После этой стадии возможны альтернативные пути. В одном из таких путей происходит перенос аденилатного остатка с образованием адениндинуклеотида никотиновой кислоты (дезамино-NAD+, NaAD), после чего остаток никотиновой кислоты в составе NaAD амидируется с образованием никотинамидадениндинуклеотида[3].
На дополнительном этапе некоторые из новообразованных NAD+ превращаются в NADP+ ферментом NAD+-киназой[en], которая фосфорилирует NAD+[24]. У большинства организмов этот фермент использует АТР в качестве донора фосфорильной группы, хотя некоторые бактерии, как, например, Mycobacterium tuberculosis и гипертермофильная архея Pyrococcus horikoshii[en] используют неорганический пирофосфат в качестве альтернативного донора фосфорильной группы[25][26].
Реутилизация
Кроме биосинтеза NAD+ de novo из аминокислот аспартата или триптофана, клетки также способны образовывать NAD+ из готовой никотиновой кислоты и некоторых её производных. Хотя известны и другие предшественники, в этих метаболических путях обычно используются три природных соединения: никотиновая кислота (Na), никотинамид (Nam) и никотинамидрибозид (NR)[3]. Эти соединения могут попадать в организм экзогенно (например, с пищей, в которой содержится смесь никотиновой кислоты и никотинамида, называемая ниацином, или витамином В3). Однако эти соединения образуются и в самой клетке, где никотинамидный остаток высвобождается из NAD+ в реакциях переноса ADP-рибозных остатков. В самом деле, ферменты, обеспечивающие образование NAD+ из готовых производных никотиновой кислоты, сконцентрированы в ядре клетки, что может компенсировать большое количество реакций, протекающих в этой органелле с потреблением NAD+[27]. Клетки также могут получать NAD+ из своего внеклеточного окружения[28].
Несмотря на наличие пути синтеза NAD+ de novo, реакции образования NAD+ из никотиновой кислоты и её производных жизненно важны для людей: при недостатке ниацина развивается заболевание пеллагра[29]. Такая высокая потребность в NAD+ обусловлена его постоянным расходованием в таких реакциях, как посттрансляционные модификации, поскольку переход NAD+ в NADH и обратно не изменяет общего количества кофермента[3].
Пути образования NAD+ из никотиновой кислоты и её производных у микроорганизмов отличаются от таковых у млекопитающих[30]. Некоторые патогены, например, дрожжи Candida glabrata[en] и бактерия Haemophilus influenzae ауксотрофны по NAD+ — они не способны синтезировать NAD+ de novo, однако такие организмы, являясь зависимыми от экзогенных предшественников NAD+, могут синтезировать NAD+ путём реутилизации определённых производных никотиновой кислоты.[31][32]. У внутриклеточного патогена Chlamydia trachomatis отсутствуют какие-либо гены, которые потенциально могут быть вовлечены в пути образования и NAD+, и NADP+, и он должен получать оба этих кофермента извне[33].
Функции
 NAD выполняет несколько важнейших функций в метаболизме. Он выступает как кофермент в окислительно-восстановительных реакциях, как обязательный кофактор (простетическая группа) ферментов (циклаз фосфорилированных углеводов, различных эпимераз и др.), как донор ADP-рибозных остатков в реакциях ADP-рибозилирования[en] (одна из реакций посттрансляционной модификации белков), как предшественник циклической ADP-рибозы, являющейся вторичным посредником, а также как субстрат для бактериальных ДНК-лигаз и группы ферментов — сиртуинов, которые используют NAD+ для удаления ацетильных групп[en] с ферментов. Кроме этих метаболических функций, NAD+ может также выполнять важные функции вне клетки, так как он может выделяться из клетки спонтанно или в результате регулируемых процессов[35][36].
NAD выполняет несколько важнейших функций в метаболизме. Он выступает как кофермент в окислительно-восстановительных реакциях, как обязательный кофактор (простетическая группа) ферментов (циклаз фосфорилированных углеводов, различных эпимераз и др.), как донор ADP-рибозных остатков в реакциях ADP-рибозилирования[en] (одна из реакций посттрансляционной модификации белков), как предшественник циклической ADP-рибозы, являющейся вторичным посредником, а также как субстрат для бактериальных ДНК-лигаз и группы ферментов — сиртуинов, которые используют NAD+ для удаления ацетильных групп[en] с ферментов. Кроме этих метаболических функций, NAD+ может также выполнять важные функции вне клетки, так как он может выделяться из клетки спонтанно или в результате регулируемых процессов[35][36].
Оксидоредуктазы
Наиболее важной функцией NAD+ в метаболизме является перенос электронов с одной молекулы на другую. Реакции такого типа катализируются большой группой ферментов, называемых оксидоредуктазами. Правильное название этих ферментов содержит название обоих их субстратов (окислителя и восстановителя), например, NADH-убихиноноксидоредуктаза[en]* катализирует перенос электронов с NADH на кофермент Q[37]. Однако, эти ферменты также называют дегидрогеназами и редуктазами: так, НАДН-убихиноноксидоредуктазу часто называют НАДН-дегидрогеназой или кофермент Q-редуктазой[38].
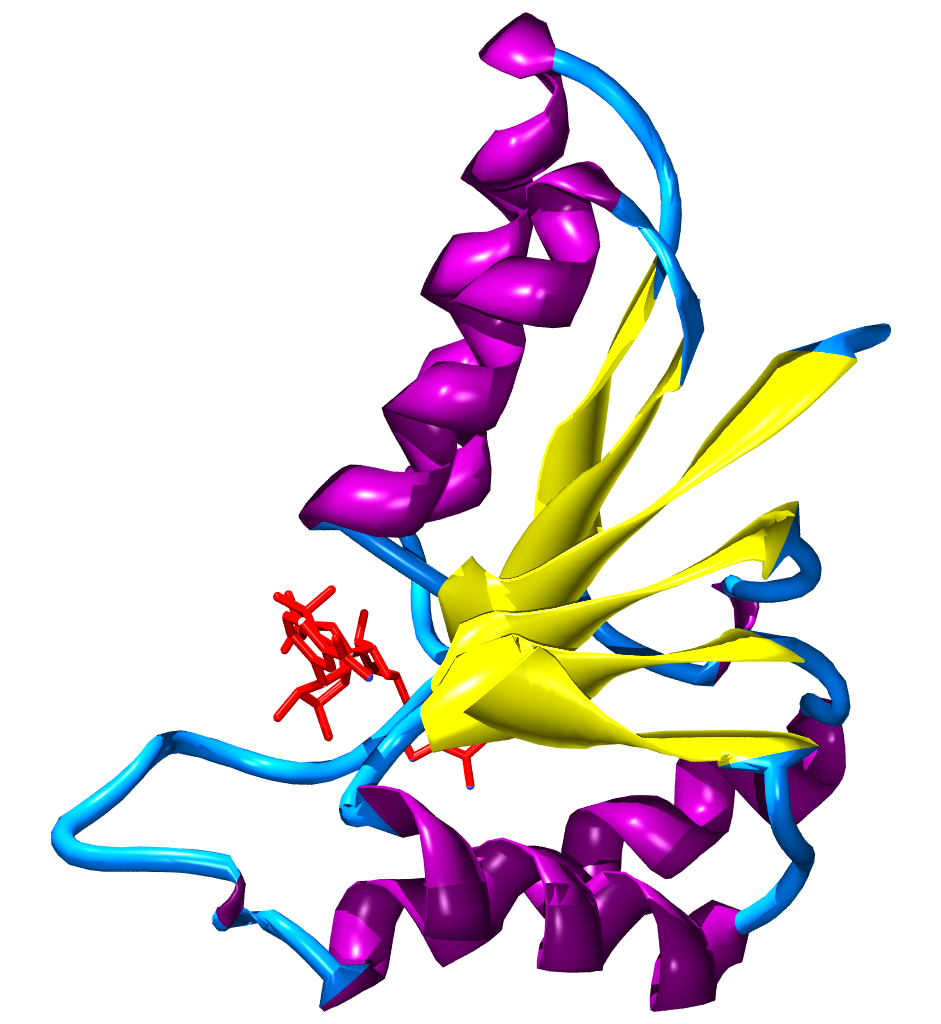
При связывании с белком NAD+ и NADH обычно располагаются в структурном мотиве[en] белка, известном как укладка Россмана[39]. Он был назван в честь Майкла Россмана[en], который был первым учёным, заметившим, что эта структура характерна для нуклеотид-связывающих белков[40]. В этом фолде имеются три или более параллельных бета-слоя, связанных двумя альфа-спиралями в порядке бета-альфа-бета-альфа-бета. В результате образуется общий бета-слой, с каждой стороны фланкированный слоем альфа-спиралей. Поскольку каждый фолд Россмана связывает лишь один нуклеотид, домены, связывающие динуклеотид NAD+, содержат два таких фолда, каждый из которых связывает один нуклеотид кофактора. Однако этот фолд не является универсальным среди NAD-зависимых ферментов; в частности, недавно был описан класс бактериальных ферментов, задействованных в метаболизме аминокислот, которые связывают NAD+, однако лишены этого мотива[41].
Связываясь с активным сайтом фермента, никотинамидный остаток NAD+ и субстрат взаимно ориентируются определённым образом, что благоприятствует эффективной передаче гидрида (H−). При изучении действия ферментов на дейтерированные субстраты было показано, что оксидоредуктазы селективно переносят гидрид к re- либо si-стороне никотинамидного остатка NAD+. В результате переноса на никотинамидный остаток D− вместо H− обазуется один из двух возможных диастереомеров NADH — это и позволяет установить, к какой именно стороне никотинамидного фрагмента NAD+ та или иная оксидоредуктаза переносит гидрид.
Высокая селективность обычно наблюдается также и в обратных процессах: оксидоредуктазы могут специфично переносить один из двух атомов водорода NADH (про-R либо про-S) к восстанавливаемому субстрату. Так, например, алкогольдегидрогеназа дрожжей и алкогольдегидрогеназы из печени человека, лошади переносят к субстрату про-R-атом водорода, а алкогольдегидрогеназа из Drosophila melanogaster производит восстановление при участии про-S-атома водорода[42]. Нативная алкогольдегидрогеназа дрожжей совершает одну «стереохимическую ошибку» на ~ 7 млрд актов катализа; показано, что мутации могут существенно снижать стереоспецифичность[43].
Эти факты нашли применение в исследованиях кинетики ферментативных реакций, а также в классификации ферментов. Оксидоредуктазы, взаимно ориентирующие субстраты таким образом, при котором гидрид атакует никотинамидный остаток с re-стороны (соответственно, в восстановленном коферменте подвижен HR), принято называть оксидоредуктазами класса A, тогда как в случае оксидоредуктаз класса B атака происходит с si-стороны (подвижен HS)[44].
При изучении ферментов, помимо описанной выше избирательности при выборе атома водорода в молекуле NADH, была обнаружена также и селективность по отношению к энантиотопным сторонам восстанавливаемого субстрата. Это указало на возможность использования ферментов в стереоселективном органическом синтезе для превращения кетонов в (R)- либо (S)-спирты.
Хотя механизмы связывания белков с NAD+ и NADP+ схожи, ферменты, как правило, демонстрируют высокую специфичность к NAD+ и NADP+[45]. Такая специфичность вытекает из различных метаболических ролей этих коферментов, и в их коферменто-связывающих сайтах располагаются различные наборы аминокислот. В частности, в активном центре NADP+-зависимых ферментов между аминокислотами основной цепочки и кислотно-фосфатной группой NADP+ образуется ионная связь, обусловленная определёнными зарядами аминокислотных остатков. В то же время в сайтах связывания с коферментом у NAD+-зависимых ферментов имеется другой набор зарядов аминокислот, что препятствует связыванию с NADP+. Впрочем, из этого общего правила существуют исключения: такие ферменты, как альдозоредуктаза[en], глюкозо-6-фосфатдегидрогеназа, метилентетрагидрофолатредуктаза у некоторых видов используют оба кофермента[46].
Роль в окислительно-восстановительных реакциях
Окислительно-восстановительные реакции, катализируемые оксидоредуктазами, составляют важнейшую часть всех метаболических путей, однако наиболее значима их роль в процессах, связанных с выделением энергии из питательных веществ. В них такие восстановленные соединения, как глюкоза и жирные кислоты, окисляясь и в связи с этим выделяют энергию. Эта энергия запасается NAD+ при его восстановлении до NADH в ряде реакций β-окисления жирных кислот, гликолиза и цикла трикарбоновых кислот. У эукариот электроны, перенесённые на восстановленный в цитоплазме NADH, переносятся в митохондрию для восстановления митохондриальных NAD+ с помощью митохондриальных челночных механизмов[en], таких как малат-аспартатный челнок[en][47]. Митохондриальный NADH затем окисляется белками электроно-транспортной цепи, которые накачивают протоны в межмембранное пространство[en] из митохондриального матрикса, и благодаря энергии протонов в ходе окислительного фосфорилирования синтезируется ATP[48]. Такую же транспортную функцию челночные системы имеют и в хлоропластах[49].
Так как в этих связанных наборах реакций используются и окисленная, и восстановленная формы NAD, клетка поддерживает определённые концентрации NAD+ и NADH, и сохраняемое большое значение отношения NAD+/NADH позволяет этому коферменту выступать и в качестве окислителя, и в качестве восстановителя[50]. У NADPH, напротив, главной задачей является служить восстановителем в анаболических процессах, в частности, он вовлечён в такие процессы, как фотосинтез и синтез жирных кислот[en]. Поскольку NADPH выступает как сильный восстановитель и благодаря этому запускает окислительно-восстановительные реакции, значение отношения NADP+/NADPH поддерживается очень низким[50].
Несмотря на важную роль в катаболизме, NADH также участвует в некоторых анаболических процессах, например, глюконеогенезе[51]. Необходимость NADH в анаболических процессах создаёт проблему для микроорганизмов, растущих на питательных веществах, дающих лишь небольшое количество энергии. Например, нитрифицирующие бактерии Nitrobacter[en] окисляют нитрит до нитрата, и выделяющейся при окислении энергии достаточно для накачивания протонов и синтеза ATP, но не для непосредственного образования NADH[52]. Так как NADH всё-таки нужен в анаболических реакциях, эти бактерии используют фермент нитритоксидоредуктазу[en], которая создаёт достаточную протонодвижущую силу для того, чтобы заставить электроны двигаться по электроно-транспортной цепи в обратном направлении, что приводит к синтезу NADH[53].
Другие внутриклеточные функции
Кофермент NAD+ также расходуется в реакциях переноса ADP-рибозных[en] остатков. Например, ферменты ADP-рибозилтрансферазы[en] присоединяют свой ADP-рибозный остаток к белкам при посттрансляционной модификации, называемой ADP-рибозилированием[en][54]. ADP-рибозилирование может включать присоединение единственного ADP-рибозного остатка (моно(ADP-рибозил)ирование) или перенос ADP-рибозных остатков на белки с образованием длинных цепей из этих остатков (поли(ADP-рибозил)ирование)[55]. Первоначально моно-ADP-рибозилирование было известно как механизм созревания бактериальных токсинов, особенно холерного токсина, однако оно задействовано и в нормальной передаче сигналов между клетками[56][57]. Поли(ADP-рибозил)ирование осуществляется ферментами поли(ADP-рибозо)-полимеразами[55][58]. Поли(ADP-рибоз)ные цепи участвуют в регуляции некоторых клеточных процессов и особенно важны в клеточном ядре, где они задействованы в репарации ДНК и поддержании теломер[58]. Кроме внутриклеточных ADP-рибозилтрансфераз, недавно была описана группа внеклеточных ADP-рибозилтрансфераз, однако их функции пока неизвестны[59]. NAD+ также может присоединяться к клеточным РНК при 5′-терминальных модификациях[60].
Другая функция NAD+ в передаче сигналов между клетками обусловлена тем, что он может служить предшественником для циклической ADP-рибозы — вторичного посредника, который образуется из NAD+ под действием ADP-рибозилциклаз[61]. Эта молекула участвует в кальциевых сигнальных путях[en], запуская высвобождение кальция из внутриклеточных депо[62]. Такое действие циклической ADP-рибозы обусловлено её связыванием и последующим открыванием кальциевых каналов, называемых рианодиновыми рецепторами[en]; эти рецепторы локализованы в мембранах органелл, например, эндоплазматического ретикулума[63].
NAD+ также используется при функционировании сиртуинов, например, Sir2[en][64]. Эти белки являются NAD-зависимыми деацетилазами. Их активность заключается в переносе ацетильных групп с субстратов-белков на ADP-рибозный остаток NAD+; это вызывает разрушение кофермента и высвобождение никотинамида и О-ацетил-ADP-рибозы. По-видимому, сиртуины участвуют в основном в регуляции транскрипции через деацетилирование гистонов и изменение структуры нуклеосом[65]. Однако сиртуины могут деацетилировать и негистоновые белки. Эта активность сиртуинов особенно интересна из-за их важной роли в регуляции старения[66].
Другими NAD-зависимыми ферментами являются бактериальные ДНК-лигазы, которые соединяют концы двух цепей ДНК, используя второй субстрат — NAD+ — как донор остатков AMP для присоединения к 5′-фосфату конца одной из цепей ДНК. Это промежуточное соединение далее атакуется 3′-гидроксильной группой конца другой цепи ДНК, и образуется новая фосфодиэфирная связь[67]. В отличие от бактериальных ДНК-лигаз, ДНК-лигазы эукариот используют ATP для образования промежуточных соединений ДНК-AMP[68].
Внеклеточные функции
В последние годы было установлено значение NAD+ как внеклеточной сигнальной молекулы, участвующей в межклеточной коммуникации[36][69][70]. NAD+ выделяется нейросекреторными клетками[en][71] и из синаптосом[en] мозга[72] в кровеносные сосуды[35], мочевой пузырь[35][73], толстую кишку[74][75]. Предполагается, что NAD+ является новым нейромедиатором, который передаёт информацию от нейронов к эффекторным клеткам[en] в гладкомышечных органах[74][75]. Необходимы дальнейшие исследования для выяснения механизмов внеклеточных действий NAD+ и их влияния на здоровье и болезни человека.
Фармакологическое и медицинское применение
Ферменты, вовлечённые в синтез и использование NAD+, имеют важное значение для фармакологии и исследований, направленных на поиск новых способов лечения болезней[76]. При разработке новых препаратов[en] NAD+ рассматривается с трёх позиций: как непосредственная мишень для лекарств, для разработки ингибиторов и активаторов ферментов, которые благодаря своей структуре изменяют активность NAD-зависимых ферментов и для изучения методов подавления биосинтеза NAD+[77].
В настоящий момент сам по себе кофермент NAD+ не используется для лечения каких бы то ни было заболеваний. Однако изучается его потенциальная роль в терапии нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона[3]. Имеются различные данные о действии NAD+ в нейродегенеративных болезнях. Некоторые исследования на мышах дают обнадёживающие результаты[78], однако клинические испытания на людях с использованием плацебо не дали какого-либо эффекта[79].
NAD+ также является непосредственной мишенью препарата изониазида, применяющегося для лечения туберкулёза — инфекции, вызываемой бактерией Mycobacterium tuberculosis. Изониазид является пролекарством и при попадании в клетку бактерии он активируется пероксидазой[en], которая окисляет это вещество в свободно-радикальную форму[80]. Этот радикал далее реагирует с NADH с образованием аддуктов, которые являются очень сильными ингибиторами ферментов редуктазы белка-переносчика еноил-ацила[en][81] и дигидрофолатредуктазы[82]. В одном эксперименте у мышей, которым давали NAD в течение недели, улучшалось взаимодействие клеточного ядра и митохондрий[83].
Из-за огромного количества оксидоредуктаз, использующих NAD+ и NADH в качестве субстратов и связывающихся с ними при помощи одного высококонсервативного структурного мотива, идея разработки ингибитора, блокирующего центр связывания NAD+, и специфичного лишь для определённого фермента, кажется сомнительной[84]. Однако это может быть выполнимым: так, ингибиторы, основанные на микофенолиновой кислоте[en] и тиазофурине[en], подавляют инозинмонофосфатдегидрогеназу[en] в сайте связывания с NAD+. Из-за важной роли этого фермента в метаболизме пуринов эти соединения могут быть полезными противораковыми и противовирусными препаратами или иммунодепрессантами[84][85]. Другие препараты являются не ингибиторами, а, наоборот, активаторами ферментов, вовлечённых в метаболизм NAD+. В частности, интересной мишенью для таких препаратов могут быть сиртуины, так как активация этих NAD-зависимых деацетилаз увеличивают продолжительность жизни[86]. Такие соединения, как ресвератрол, увеличивают активность этих ферментов, которые могут иметь большое значение благодаря их способности к переносу старения на более позднее время как у позвоночных[87], так и модельных организмов из числа беспозвоночных[88][89].
Из-за различий путей биосинтеза NAD+ у различных организмов, в частности, между бактериями и человеком, биосинтез NAD+ может стать новой сферой развития новых антибиотиков[90][91]. Например, фермент никотинамидаза[en], превращающая никотинамид в никотиновую кислоту, служит мишенью разрабатываемых лекарств, так как этот фермент отсутствует у человека, но имеется у бактерий и дрожжей[30].
История
 Кофермент NAD+ был открыт английскими биохимиками Артуром Харденом и Уильямом Джоном Янгом[en] в 1906 году[92]. Они заметили, что добавление прокипячённого и профильтрованного экстракта дрожжей к непрокипячённым экстрактам значительно усиливало спиртовое брожение у последних. Неизвестный фактор, ответственный за это явление, они назвали коферментом. В ходе длительного и сложного выделения из экстрактов дрожжей этот теплостойкий фактор был идентифицирован как нуклеотид-сахарофосфат Хансом фон Эйлер-Хельпин[93]. В 1936 году немецкий учёный Отто Генрих Варбург установил функцию этого кофермента по переносу гидридного иона и определил, что в окислительно-восстановительных реакциях участвует никотинамидный остаток[94].
Кофермент NAD+ был открыт английскими биохимиками Артуром Харденом и Уильямом Джоном Янгом[en] в 1906 году[92]. Они заметили, что добавление прокипячённого и профильтрованного экстракта дрожжей к непрокипячённым экстрактам значительно усиливало спиртовое брожение у последних. Неизвестный фактор, ответственный за это явление, они назвали коферментом. В ходе длительного и сложного выделения из экстрактов дрожжей этот теплостойкий фактор был идентифицирован как нуклеотид-сахарофосфат Хансом фон Эйлер-Хельпин[93]. В 1936 году немецкий учёный Отто Генрих Варбург установил функцию этого кофермента по переносу гидридного иона и определил, что в окислительно-восстановительных реакциях участвует никотинамидный остаток[94].
Источник никотинамида был определён в 1938 году, когда Конрад Элведжем[en] выделил ниацин из печени и показал, что этот витамин содержит никотиновую кислоту и никотинамид[95]. Позднее, в 1939 году, он предоставил первое убедительное доказательство того, что ниацин используется для образования NAD+[96]. В начале 1940-х Артур Корнберг сделал следующий шаг к пониманию роли NAD+ в метаболизме: он первым установил присутствие этого кофермента в биосинтетических путях[97]. Далее, в 1949 году американские биохимики Моррис Фридкин и Альберт Ленинджер доказали, что NAD+ связан с такими метаболическими путями, как цикл трикарбоновых кислот и окислительное фосфорилирование[98]. Наконец, в 1959 году Джек Присс (англ. Jack Preiss) и Филип Хандлер (англ. Philip Handler) описали ферменты и промежуточные соединения биосинтеза NAD+[99][100], поэтому путь синтеза NAD+ de novo часто называют путём Присса — Хандлера в их честь.
Функции NAD и NADP, не связанные с окислительно-восстановительными реакциями, были открыты лишь в недавнее время[2]. Такой первой открытой функцией NAD+ было участие в качестве донора ADP-рибозного остатка в реакциях ADP-рибозилирования; это было установлено в начале 1960-х[101]. Более поздние исследования 1980-х и 1990-х годов показали участие NAD+ и NADP+ в передаче сигнала между клетками. В частности, действие циклической ADP-рибозы было установлено в 1987 году[102]. Метаболизм NAD+ и в XXI остаётся в сфере интенсивных исследований. Этот интерес особенно возрос после открытия в 2000 году Шинихиро Имаи (англ. Shinichiro Imai) и сотрудниками из Массачусетского технологического института NAD+-зависимых деацетилаз — сиртуинов[103].
См. также
Напишите отзыв о статье "Никотинамидадениндинуклеотид"
Примечания
- ↑ [catalog.hardydiagnostics.com/cp_prod/content/hugo/XVFactorDisks.htm X- AND V-FACTOR DISKS].
- ↑ 1 2 3 Pollak N., Dölle C., Ziegler M. [www.ncbi.nlm.nih.gov/pubmed/17295611 The power to reduce: pyridine nucleotides--small molecules with a multitude of functions.] (англ.) // The Biochemical journal. — 2007. — Vol. 402, no. 2. — P. 205—218. — DOI:10.1042/BJ20061638. — PMID 17295611.
- ↑ 1 2 3 4 5 6 Belenky P., Bogan K. L., Brenner C. [www.ncbi.nlm.nih.gov/pubmed/17161604 NAD+ metabolism in health and disease.] (англ.) // Trends in biochemical sciences. — 2007. — Vol. 32, no. 1. — P. 12—19. — DOI:10.1016/j.tibs.2006.11.006. — PMID 17161604.
- ↑ Unden G., Bongaerts J. [www.ncbi.nlm.nih.gov/pubmed/9230919 Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors.] (англ.) // Biochimica et biophysica acta. — 1997. — Vol. 1320, no. 3. — P. 217—234. — PMID 9230919.
- ↑ Windholz, Martha. The Merck Index: an encyclopedia of chemicals, drugs, and biologicals. — 10th. — Rahway NJ, US: Merck, 1983. — P. 909. — ISBN 0-911910-27-1.
- ↑ Biellmann J. F., Lapinte C., Haid E., Weimann G. [www.ncbi.nlm.nih.gov/pubmed/218616 Structure of lactate dehydrogenase inhibitor generated from coenzyme.] (англ.) // Biochemistry. — 1979. — Vol. 18, no. 7. — P. 1212—1217. — PMID 218616.
- ↑ 1 2 Dawson, R. Ben. Data for biochemical research. — 3rd. — Oxford: Clarendon Press, 1985. — P. 122. — ISBN 0-19-855358-7.
- ↑ 1 2 Lakowicz J. R., Szmacinski H., Nowaczyk K., Johnson M. L. [www.ncbi.nlm.nih.gov/pubmed/1741380 Fluorescence lifetime imaging of free and protein-bound NADH.] (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1992. — Vol. 89, no. 4. — P. 1271—1275. — PMID 1741380.
- ↑ Jameson D. M., Thomas V., Zhou D. M. [www.ncbi.nlm.nih.gov/pubmed/2910350 Time-resolved fluorescence studies on NADH bound to mitochondrial malate dehydrogenase.] (англ.) // Biochimica et biophysica acta. — 1989. — Vol. 994, no. 2. — P. 187—190. — PMID 2910350.
- ↑ Kasimova M. R., Grigiene J., Krab K., Hagedorn P. H., Flyvbjerg H., Andersen P. E., Møller I. M. [www.ncbi.nlm.nih.gov/pubmed/16461578 The free NADH concentration is kept constant in plant mitochondria under different metabolic conditions.] (англ.) // The Plant cell. — 2006. — Vol. 18, no. 3. — P. 688—698. — DOI:10.1105/tpc.105.039354. — PMID 16461578.
- ↑ Reiss P. D., Zuurendonk P. F., Veech R. L. [www.ncbi.nlm.nih.gov/pubmed/6486402 Measurement of tissue purine, pyrimidine, and other nucleotides by radial compression high-performance liquid chromatography.] (англ.) // Analytical biochemistry. — 1984. — Vol. 140, no. 1. — P. 162—171. — PMID 6486402.
- ↑ Yamada K., Hara N., Shibata T., Osago H., Tsuchiya M. [www.ncbi.nlm.nih.gov/pubmed/16574057 The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry.] (англ.) // Analytical biochemistry. — 2006. — Vol. 352, no. 2. — P. 282—285. — DOI:10.1016/j.ab.2006.02.017. — PMID 16574057.
- ↑ 1 2 Yang H., Yang T., Baur J. A., Perez E., Matsui T., Carmona J. J., Lamming D. W., Souza-Pinto N. C., Bohr V. A., Rosenzweig A., de Cabo R., Sauve A. A., Sinclair D. A. [www.ncbi.nlm.nih.gov/pubmed/17889652 Nutrient-sensitive mitochondrial NAD+ levels dictate cell survival.] (англ.) // Cell. — 2007. — Vol. 130, no. 6. — P. 1095—1107. — DOI:10.1016/j.cell.2007.07.035. — PMID 17889652.
- ↑ Belenky P., Racette F. G., Bogan K. L., McClure J. M., Smith J. S., Brenner C. [www.ncbi.nlm.nih.gov/pubmed/17482543 Nicotinamide riboside promotes Sir2 silencing and extends lifespan via Nrk and Urh1/Pnp1/Meu1 pathways to NAD+.] (англ.) // Cell. — 2007. — Vol. 129, no. 3. — P. 473—484. — DOI:10.1016/j.cell.2007.03.024. — PMID 17482543.
- ↑ Blinova K., Carroll S., Bose S., Smirnov A. V., Harvey J. J., Knutson J. R., Balaban R. S. [www.ncbi.nlm.nih.gov/pubmed/15709771 Distribution of mitochondrial NADH fluorescence lifetimes: steady-state kinetics of matrix NADH interactions.] (англ.) // Biochemistry. — 2005. — Vol. 44, no. 7. — P. 2585—2594. — DOI:10.1021/bi0485124. — PMID 15709771.
- ↑ Todisco S., Agrimi G., Castegna A., Palmieri F. [www.ncbi.nlm.nih.gov/pubmed/16291748 Identification of the mitochondrial NAD+ transporter in Saccharomyces cerevisiae.] (англ.) // The Journal of biological chemistry. — 2006. — Vol. 281, no. 3. — P. 1524—1531. — DOI:10.1074/jbc.M510425200. — PMID 16291748.
- ↑ Schafer F. Q., Buettner G. R. [www.ncbi.nlm.nih.gov/pubmed/11368918 Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple.] (англ.) // Free radical biology & medicine. — 2001. — Vol. 30, no. 11. — P. 1191—1212. — PMID 11368918.
- ↑ Williamson D. H., Lund P., Krebs H. A. [www.ncbi.nlm.nih.gov/pubmed/4291787 The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver.] (англ.) // The Biochemical journal. — 1967. — Vol. 103, no. 2. — P. 514—527. — PMID 4291787.
- ↑ Zhang Q., Piston D. W., Goodman R. H. [www.ncbi.nlm.nih.gov/pubmed/11847309 Regulation of corepressor function by nuclear NADH.] (англ.) // Science (New York, N.Y.). — 2002. — Vol. 295, no. 5561. — P. 1895—1897. — DOI:10.1126/science.1069300. — PMID 11847309.
- ↑ Lin S. J., Guarente L. [www.ncbi.nlm.nih.gov/pubmed/12648681 Nicotinamide adenine dinucleotide, a metabolic regulator of transcription, longevity and disease.] (англ.) // Current opinion in cell biology. — 2003. — Vol. 15, no. 2. — P. 241—246. — PMID 12648681.
- ↑ Veech R. L., Eggleston L. V., Krebs H. A. [www.ncbi.nlm.nih.gov/pubmed/4391039 The redox state of free nicotinamide-adenine dinucleotide phosphate in the cytoplasm of rat liver.] (англ.) // The Biochemical journal. — 1969. — Vol. 115, no. 4. — P. 609—619. — PMID 4391039.
- ↑ Katoh A., Uenohara K., Akita M., Hashimoto T. [www.ncbi.nlm.nih.gov/pubmed/16698895 Early steps in the biosynthesis of NAD in Arabidopsis start with aspartate and occur in the plastid.] (англ.) // Plant physiology. — 2006. — Vol. 141, no. 3. — P. 851—857. — DOI:10.1104/pp.106.081091. — PMID 16698895.
- ↑ Foster J. W., Moat A. G. [www.ncbi.nlm.nih.gov/pubmed/6997723 Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems.] (англ.) // Microbiological reviews. — 1980. — Vol. 44, no. 1. — P. 83—105. — PMID 6997723.
- ↑ Magni G., Orsomando G., Raffaelli N. [www.ncbi.nlm.nih.gov/pubmed/16842123 Structural and functional properties of NAD kinase, a key enzyme in NADP biosynthesis.] (англ.) // Mini reviews in medicinal chemistry. — 2006. — Vol. 6, no. 7. — P. 739—746. — PMID 16842123.
- ↑ Sakuraba H., Kawakami R., Ohshima T. [www.ncbi.nlm.nih.gov/pubmed/16085824 First archaeal inorganic polyphosphate/ATP-dependent NAD kinase, from hyperthermophilic archaeon Pyrococcus horikoshii: cloning, expression, and characterization.] (англ.) // Applied and environmental microbiology. — 2005. — Vol. 71, no. 8. — P. 4352—4358. — DOI:10.1128/AEM.71.8.4352-4358.2005. — PMID 16085824.
- ↑ Raffaelli N., Finaurini L., Mazzola F., Pucci L., Sorci L., Amici A., Magni G. [www.ncbi.nlm.nih.gov/pubmed/15182203 Characterization of Mycobacterium tuberculosis NAD kinase: functional analysis of the full-length enzyme by site-directed mutagenesis.] (англ.) // Biochemistry. — 2004. — Vol. 43, no. 23. — P. 7610—7617. — DOI:10.1021/bi049650w. — PMID 15182203.
- ↑ Anderson R. M., Bitterman K. J., Wood J. G., Medvedik O., Cohen H., Lin S. S., Manchester J. K., Gordon J. I., Sinclair D. A. [www.ncbi.nlm.nih.gov/pubmed/11884393 Manipulation of a nuclear NAD+ salvage pathway delays aging without altering steady-state NAD+ levels.] (англ.) // The Journal of biological chemistry. — 2002. — Vol. 277, no. 21. — P. 18881—18890. — DOI:10.1074/jbc.M111773200. — PMID 11884393.
- ↑ Billington R. A., Travelli C., Ercolano E., Galli U., Roman C. B., Grolla A. A., Canonico P. L., Condorelli F., Genazzani A. A. [www.ncbi.nlm.nih.gov/pubmed/18180302 Characterization of NAD uptake in mammalian cells.] (англ.) // The Journal of biological chemistry. — 2008. — Vol. 283, no. 10. — P. 6367—6374. — DOI:10.1074/jbc.M706204200. — PMID 18180302.
- ↑ Henderson L. M. [www.ncbi.nlm.nih.gov/pubmed/6357238 Niacin.] (англ.) // Annual review of nutrition. — 1983. — Vol. 3. — P. 289—307. — DOI:10.1146/annurev.nu.03.070183.001445. — PMID 6357238.
- ↑ 1 2 Rongvaux A., Andris F., Van Gool F., Leo O. [www.ncbi.nlm.nih.gov/pubmed/12815723 Reconstructing eukaryotic NAD metabolism.] (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2003. — Vol. 25, no. 7. — P. 683—690. — DOI:10.1002/bies.10297. — PMID 12815723.
- ↑ Ma B., Pan S. J., Zupancic M. L., Cormack B. P. [www.ncbi.nlm.nih.gov/pubmed/17725566 Assimilation of NAD(+) precursors in Candida glabrata.] (англ.) // Molecular microbiology. — 2007. — Vol. 66, no. 1. — P. 14—25. — DOI:10.1111/j.1365-2958.2007.05886.x. — PMID 17725566.
- ↑ Reidl J., Schlör S., Kraiss A., Schmidt-Brauns J., Kemmer G., Soleva E. [www.ncbi.nlm.nih.gov/pubmed/10760156 NADP and NAD utilization in Haemophilus influenzae.] (англ.) // Molecular microbiology. — 2000. — Vol. 35, no. 6. — P. 1573—1581. — PMID 10760156.
- ↑ Gerdes S. Y., Scholle M. D., D'Souza M., Bernal A., Baev M. V., Farrell M., Kurnasov O. V., Daugherty M. D., Mseeh F., Polanuyer B. M., Campbell J. W., Anantha S., Shatalin K. Y., Chowdhury S. A., Fonstein M. Y., Osterman A. L. [www.ncbi.nlm.nih.gov/pubmed/12142426 From genetic footprinting to antimicrobial drug targets: examples in cofactor biosynthetic pathways.] (англ.) // Journal of bacteriology. — 2002. — Vol. 184, no. 16. — P. 4555—4572. — PMID 12142426.
- ↑ Senkovich O., Speed H., Grigorian A., Bradley K., Ramarao C. S., Lane B., Zhu G., Chattopadhyay D. [www.ncbi.nlm.nih.gov/pubmed/15953771 Crystallization of three key glycolytic enzymes of the opportunistic pathogen Cryptosporidium parvum.] (англ.) // Biochimica et biophysica acta. — 2005. — Vol. 1750, no. 2. — P. 166—172. — DOI:10.1016/j.bbapap.2005.04.009. — PMID 15953771.
- ↑ 1 2 3 Smyth L. M., Bobalova J., Mendoza M. G., Lew C., Mutafova-Yambolieva V. N. [www.ncbi.nlm.nih.gov/pubmed/15364945 Release of beta-nicotinamide adenine dinucleotide upon stimulation of postganglionic nerve terminals in blood vessels and urinary bladder.] (англ.) // The Journal of biological chemistry. — 2004. — Vol. 279, no. 47. — P. 48893—48903. — DOI:10.1074/jbc.M407266200. — PMID 15364945.
- ↑ 1 2 Billington R. A., Bruzzone S., De Flora A., Genazzani A. A., Koch-Nolte F., Ziegler M., Zocchi E. [www.ncbi.nlm.nih.gov/pubmed/17380199 Emerging functions of extracellular pyridine nucleotides.] (англ.) // Molecular medicine (Cambridge, Mass.). — 2006. — Vol. 12, no. 11-12. — P. 324—327. — DOI:10.2119/2006–00075.Billington. — PMID 17380199.
- ↑ [www.chem.qmul.ac.uk/iubmb/enzyme Enzyme Nomenclature, Recommendations for enzyme names from the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology]. Проверено 6 декабря 2007.
- ↑ [www.expasy.org/enzyme/1.6.5.3 NiceZyme View of ENZYME: EC 1.6.5.3]. Expasy. Проверено 16 декабря 2007.
- ↑ Lesk A. M. [www.ncbi.nlm.nih.gov/pubmed/8749365 NAD-binding domains of dehydrogenases.] (англ.) // Current opinion in structural biology. — 1995. — Vol. 5, no. 6. — P. 775—783. — PMID 8749365.
- ↑ Rao S. T., Rossmann M. G. [www.ncbi.nlm.nih.gov/pubmed/4737475 Comparison of super-secondary structures in proteins.] (англ.) // Journal of molecular biology. — 1973. — Vol. 76, no. 2. — P. 241—256. — PMID 4737475.
- ↑ Goto M., Muramatsu H., Mihara H., Kurihara T., Esaki N., Omi R., Miyahara I., Hirotsu K. [www.ncbi.nlm.nih.gov/pubmed/16192274 Crystal structures of Delta1-piperideine-2-carboxylate/Delta1-pyrroline-2-carboxylate reductase belonging to a new family of NAD(P)H-dependent oxidoreductases: conformational change, substrate recognition, and stereochemistry of the reaction.] (англ.) // The Journal of biological chemistry. — 2005. — Vol. 280, no. 49. — P. 40875—40884. — DOI:10.1074/jbc.M507399200. — PMID 16192274.
- ↑ Chi-Huey Wong, G. M. Whitesides. Enzymes in Synthetic Organic Chemistry. — Oxford: Elsevier Science, 1994. — Т. 12. — С. 153—154. — 370 с. — (Tetrahedron Organic Chemistry). — ISBN 0080359426.
- ↑ Elmar G. Weinhold, Arthur Glasfeld, Andrew D. Ellington, аnd Steven A. Benner [www.ncbi.nlm.nih.gov/pmc/articles/PMC52520/pdf/pnas01069-0149.pdf Structural determinants of stereospecificity in yeast alcohol dehydrogenase] (англ.) // Proceedings of the National Academy of Sciences U.S.A. : Научный журнал. — 1991. — Vol. 88, no. 19. — P. 8420—8424. — PMID 1924300.
- ↑ Bellamacina C. R. [www.ncbi.nlm.nih.gov/pubmed/8836039 The nicotinamide dinucleotide binding motif: a comparison of nucleotide binding proteins.] (англ.) // FASEB journal : official publication of the Federation of American Societies for Experimental Biology. — 1996. — Vol. 10, no. 11. — P. 1257—1269. — PMID 8836039.
- ↑ Carugo O., Argos P. [www.ncbi.nlm.nih.gov/pubmed/9144787 NADP-dependent enzymes. I: Conserved stereochemistry of cofactor binding.] (англ.) // Proteins. — 1997. — Vol. 28, no. 1. — P. 10—28. — PMID 9144787.
- ↑ Vickers T. J., Orsomando G., de la Garza R. D., Scott D. A., Kang S. O., Hanson A. D., Beverley S. M. [www.ncbi.nlm.nih.gov/pubmed/17032644 Biochemical and genetic analysis of methylenetetrahydrofolate reductase in Leishmania metabolism and virulence.] (англ.) // The Journal of biological chemistry. — 2006. — Vol. 281, no. 50. — P. 38150—38158. — DOI:10.1074/jbc.M608387200. — PMID 17032644.
- ↑ Bakker B. M., Overkamp K. M., van Maris A. J., Kötter P., Luttik M. A., van Dijken J. P., Pronk J. T. [www.ncbi.nlm.nih.gov/pubmed/11152939 Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae.] (англ.) // FEMS microbiology reviews. — 2001. — Vol. 25, no. 1. — P. 15—37. — PMID 11152939.
- ↑ Rich P. R. [www.ncbi.nlm.nih.gov/pubmed/14641005 The molecular machinery of Keilin's respiratory chain.] (англ.) // Biochemical Society transactions. — 2003. — Vol. 31, no. Pt 6. — P. 1095—1105. — DOI:10.1042/. — PMID 14641005.
- ↑ Heineke D., Riens B., Grosse H., Hoferichter P., Peter U., Flügge U. I., Heldt H. W. [www.ncbi.nlm.nih.gov/pubmed/16668101 Redox Transfer across the Inner Chloroplast Envelope Membrane.] (англ.) // Plant physiology. — 1991. — Vol. 95, no. 4. — P. 1131—1137. — PMID 16668101.
- ↑ 1 2 Nicholls DG. Bioenergetics 3. — 1st. — Academic Press, 2002. — ISBN 0-12-518121-3.
- ↑ Sistare F. D., Haynes R. C. Jr. [www.ncbi.nlm.nih.gov/pubmed/4044607 The interaction between the cytosolic pyridine nucleotide redox potential and gluconeogenesis from lactate/pyruvate in isolated rat hepatocytes. Implications for investigations of hormone action.] (англ.) // The Journal of biological chemistry. — 1985. — Vol. 260, no. 23. — P. 12748—12753. — PMID 4044607.
- ↑ Freitag A, Bock E (1990). «Energy conservation in Nitrobacter». FEMS Microbiology Letters 66 (1–3): 157–62. DOI:10.1111/j.1574-6968.1990.tb03989.x.
- ↑ Starkenburg S. R., Chain P. S., Sayavedra-Soto L. A., Hauser L., Land M. L., Larimer F. W., Malfatti S. A., Klotz M. G., Bottomley P. J., Arp D. J., Hickey W. J. [www.ncbi.nlm.nih.gov/pubmed/16517654 Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255.] (англ.) // Applied and environmental microbiology. — 2006. — Vol. 72, no. 3. — P. 2050—2063. — DOI:10.1128/AEM.72.3.2050-2063.2006. — PMID 16517654.
- ↑ Ziegler M. [www.ncbi.nlm.nih.gov/pubmed/10712584 New functions of a long-known molecule. Emerging roles of NAD in cellular signaling.] (англ.) // European journal of biochemistry / FEBS. — 2000. — Vol. 267, no. 6. — P. 1550—1564. — PMID 10712584.
- ↑ 1 2 Diefenbach J., Bürkle A. [www.ncbi.nlm.nih.gov/pubmed/15868397 Introduction to poly(ADP-ribose) metabolism.] (англ.) // Cellular and molecular life sciences : CMLS. — 2005. — Vol. 62, no. 7-8. — P. 721—730. — DOI:10.1007/s00018-004-4503-3. — PMID 15868397.
- ↑ Berger F., Ramírez-Hernández M. H., Ziegler M. [www.ncbi.nlm.nih.gov/pubmed/15003268 The new life of a centenarian: signalling functions of NAD(P).] (англ.) // Trends in biochemical sciences. — 2004. — Vol. 29, no. 3. — P. 111—118. — DOI:10.1016/j.tibs.2004.01.007. — PMID 15003268.
- ↑ Corda D., Di Girolamo M. [www.ncbi.nlm.nih.gov/pubmed/12727863 Functional aspects of protein mono-ADP-ribosylation.] (англ.) // The EMBO journal. — 2003. — Vol. 22, no. 9. — P. 1953—1958. — DOI:10.1093/emboj/cdg209. — PMID 12727863.
- ↑ 1 2 Bürkle A. [www.ncbi.nlm.nih.gov/pubmed/16156780 Poly(ADP-ribose). The most elaborate metabolite of NAD+.] (англ.) // The FEBS journal. — 2005. — Vol. 272, no. 18. — P. 4576—4589. — DOI:10.1111/j.1742-4658.2005.04864.x. — PMID 16156780.
- ↑ Seman M., Adriouch S., Haag F., Koch-Nolte F. [www.ncbi.nlm.nih.gov/pubmed/15078170 Ecto-ADP-ribosyltransferases (ARTs): emerging actors in cell communication and signaling.] (англ.) // Current medicinal chemistry. — 2004. — Vol. 11, no. 7. — P. 857—872. — PMID 15078170.
- ↑ Chen Y. G., Kowtoniuk W. E., Agarwal I., Shen Y., Liu D. R. [www.ncbi.nlm.nih.gov/pubmed/19820715 LC/MS analysis of cellular RNA reveals NAD-linked RNA.] (англ.) // Nature chemical biology. — 2009. — Vol. 5, no. 12. — P. 879—881. — DOI:10.1038/nchembio.235. — PMID 19820715.
- ↑ Guse A. H. [www.ncbi.nlm.nih.gov/pubmed/15078169 Biochemistry, biology, and pharmacology of cyclic adenosine diphosphoribose (cADPR).] (англ.) // Current medicinal chemistry. — 2004. — Vol. 11, no. 7. — P. 847—855. — PMID 15078169.
- ↑ Guse A. H. [www.ncbi.nlm.nih.gov/pubmed/15101682 Regulation of calcium signaling by the second messenger cyclic adenosine diphosphoribose (cADPR).] (англ.) // Current molecular medicine. — 2004. — Vol. 4, no. 3. — P. 239—248. — PMID 15101682.
- ↑ Guse A. H. [www.ncbi.nlm.nih.gov/pubmed/16156781 Second messenger function and the structure-activity relationship of cyclic adenosine diphosphoribose (cADPR).] (англ.) // The FEBS journal. — 2005. — Vol. 272, no. 18. — P. 4590—4597. — DOI:10.1111/j.1742-4658.2005.04863.x. — PMID 16156781.
- ↑ North B. J., Verdin E. [www.ncbi.nlm.nih.gov/pubmed/15128440 Sirtuins: Sir2-related NAD-dependent protein deacetylases.] (англ.) // Genome biology. — 2004. — Vol. 5, no. 5. — P. 224. — DOI:10.1186/gb-2004-5-5-224. — PMID 15128440.
- ↑ Blander G., Guarente L. [www.ncbi.nlm.nih.gov/pubmed/15189148 The Sir2 family of protein deacetylases.] (англ.) // Annual review of biochemistry. — 2004. — Vol. 73. — P. 417—435. — DOI:10.1146/annurev.biochem.73.011303.073651. — PMID 15189148.
- ↑ PMID 17100594 (PMID [www.ncbi.nlm.nih.gov/pubmed/17100594 17100594])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=17100594&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 11442824 (PMID [www.ncbi.nlm.nih.gov/pubmed/11442824 11442824])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11442824&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 9271115 (PMID [www.ncbi.nlm.nih.gov/pubmed/9271115 9271115])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=9271115&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 15352307 (PMID [www.ncbi.nlm.nih.gov/pubmed/15352307 15352307])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=15352307&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 21443875 (PMID [www.ncbi.nlm.nih.gov/pubmed/21443875 21443875])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=21443875&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 19712094 (PMID [www.ncbi.nlm.nih.gov/pubmed/19712094 19712094])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=19712094&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 22276961 (PMID [www.ncbi.nlm.nih.gov/pubmed/22276961 22276961])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=22276961&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 16189287 (PMID [www.ncbi.nlm.nih.gov/pubmed/16189287 16189287])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16189287&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ 1 2 PMID 17913880 (PMID [www.ncbi.nlm.nih.gov/pubmed/17913880 17913880])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=17913880&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ 1 2 PMID 20875415 (PMID [www.ncbi.nlm.nih.gov/pubmed/20875415 20875415])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=20875415&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 18165311 (PMID [www.ncbi.nlm.nih.gov/pubmed/18165311 18165311])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=18165311&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 17465726 (PMID [www.ncbi.nlm.nih.gov/pubmed/17465726 17465726])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=17465726&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 16988050 (PMID [www.ncbi.nlm.nih.gov/pubmed/16988050 16988050])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16988050&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 9805207 (PMID [www.ncbi.nlm.nih.gov/pubmed/9805207 9805207])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=9805207&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 17074073 (PMID [www.ncbi.nlm.nih.gov/pubmed/17074073 17074073])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=17074073&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 14623976 (PMID [www.ncbi.nlm.nih.gov/pubmed/14623976 14623976])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=14623976&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 16648861 (PMID [www.ncbi.nlm.nih.gov/pubmed/16648861 16648861])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16648861&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 24360282 (PMID [www.ncbi.nlm.nih.gov/pubmed/24360282 24360282])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=24360282&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ 1 2 PMID 15083807 (PMID [www.ncbi.nlm.nih.gov/pubmed/15083807 15083807])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=15083807&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 10390603 (PMID [www.ncbi.nlm.nih.gov/pubmed/10390603 10390603])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=10390603&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 19017485 (PMID [www.ncbi.nlm.nih.gov/pubmed/19017485 19017485])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=19017485&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 16461283 (PMID [www.ncbi.nlm.nih.gov/pubmed/16461283 16461283])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16461283&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 12939617 (PMID [www.ncbi.nlm.nih.gov/pubmed/12939617 12939617])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=12939617&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 15254550 (PMID [www.ncbi.nlm.nih.gov/pubmed/15254550 15254550])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=15254550&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 12504674 (PMID [www.ncbi.nlm.nih.gov/pubmed/12504674 12504674])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=12504674&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 11153263 (PMID [www.ncbi.nlm.nih.gov/pubmed/11153263 11153263])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11153263&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ A. Harden, W. J. Young (24 October 1906). «The alcoholic ferment of yeast-juice Part II.--The coferment of yeast-juice» 78 (526): 369–375.
- ↑ [nobelprize.org/nobel_prizes/chemistry/laureates/1929/euler-chelpin-lecture.pdf Fermentation of sugars and fermentative enzymes] (PDF). Nobel Lecture, 23 May 1930. Nobel Foundation. Проверено 30 сентября 2007.
- ↑ Warburg O, Christian W. (1936). «Pyridin, der wasserstoffübertragende bestandteil von gärungsfermenten (pyridin-nucleotide)» (German). Biochemische Zeitschrift 287. DOI:10.1002/hlca.193601901199.
- ↑ Elvehjem CA, Madden RJ, Strong FM, Woolley DW (1938). «[www.jbc.org/cgi/reprint/123/1/137.pdf The isolation and identification of the anti-black tongue factor]» (PDF). J. Biol. Chem. 123 (1): 137–49.
- ↑ Axelrod AE, Madden RJ, Elvehjem CA (1939). «[www.jbc.org/cgi/reprint/131/1/85.pdf The effect of a nicotinic acid deficiency upon the coenzyme I content of animal tissues]» (PDF). J. Biol. Chem. 131 (1): 85–93.
- ↑ PMID 18098602 (PMID [www.ncbi.nlm.nih.gov/pubmed/18098602 18098602])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=18098602&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 18116985 (PMID [www.ncbi.nlm.nih.gov/pubmed/18116985 18116985])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=18116985&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 13563526 (PMID [www.ncbi.nlm.nih.gov/pubmed/13563526 13563526])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=13563526&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 13563527 (PMID [www.ncbi.nlm.nih.gov/pubmed/13563527 13563527])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=13563527&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 14019961 (PMID [www.ncbi.nlm.nih.gov/pubmed/14019961 14019961])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=14019961&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 3496336 (PMID [www.ncbi.nlm.nih.gov/pubmed/3496336 3496336])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=3496336&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота]. - ↑ PMID 10693811 (PMID [www.ncbi.nlm.nih.gov/pubmed/10693811 10693811])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=10693811&page_out=%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%B4%D0%B0%D0%B4%D0%B5%D0%BD%D0%B8%D0%BD%D0%B4%D0%B8%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%BE%D1%82%D0%B8%D0%B4 бота].
Литература
- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells.. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Campbell N. A., Reece J. B., Urry L. A. e. a. Biology. 9th ed. — Benjamin Cummings, 2011. — 1263 p. — ISBN 978-0-321-55823-7.
- Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
| ||||||||||||||
| Эта статья входит в число хороших статей русскоязычного раздела Википедии. |
Отрывок, характеризующий Никотинамидадениндинуклеотид
– А! Княжна Марья! – вдруг сказал он неестественно и бросил стамеску. (Колесо еще вертелось от размаха. Княжна Марья долго помнила этот замирающий скрип колеса, который слился для нее с тем,что последовало.)Княжна Марья подвинулась к нему, увидала его лицо, и что то вдруг опустилось в ней. Глаза ее перестали видеть ясно. Она по лицу отца, не грустному, не убитому, но злому и неестественно над собой работающему лицу, увидала, что вот, вот над ней повисло и задавит ее страшное несчастие, худшее в жизни, несчастие, еще не испытанное ею, несчастие непоправимое, непостижимое, смерть того, кого любишь.
– Mon pere! Andre? [Отец! Андрей?] – Сказала неграциозная, неловкая княжна с такой невыразимой прелестью печали и самозабвения, что отец не выдержал ее взгляда, и всхлипнув отвернулся.
– Получил известие. В числе пленных нет, в числе убитых нет. Кутузов пишет, – крикнул он пронзительно, как будто желая прогнать княжну этим криком, – убит!
Княжна не упала, с ней не сделалось дурноты. Она была уже бледна, но когда она услыхала эти слова, лицо ее изменилось, и что то просияло в ее лучистых, прекрасных глазах. Как будто радость, высшая радость, независимая от печалей и радостей этого мира, разлилась сверх той сильной печали, которая была в ней. Она забыла весь страх к отцу, подошла к нему, взяла его за руку, потянула к себе и обняла за сухую, жилистую шею.
– Mon pere, – сказала она. – Не отвертывайтесь от меня, будемте плакать вместе.
– Мерзавцы, подлецы! – закричал старик, отстраняя от нее лицо. – Губить армию, губить людей! За что? Поди, поди, скажи Лизе. – Княжна бессильно опустилась в кресло подле отца и заплакала. Она видела теперь брата в ту минуту, как он прощался с ней и с Лизой, с своим нежным и вместе высокомерным видом. Она видела его в ту минуту, как он нежно и насмешливо надевал образок на себя. «Верил ли он? Раскаялся ли он в своем неверии? Там ли он теперь? Там ли, в обители вечного спокойствия и блаженства?» думала она.
– Mon pere, [Отец,] скажите мне, как это было? – спросила она сквозь слезы.
– Иди, иди, убит в сражении, в котором повели убивать русских лучших людей и русскую славу. Идите, княжна Марья. Иди и скажи Лизе. Я приду.
Когда княжна Марья вернулась от отца, маленькая княгиня сидела за работой, и с тем особенным выражением внутреннего и счастливо спокойного взгляда, свойственного только беременным женщинам, посмотрела на княжну Марью. Видно было, что глаза ее не видали княжну Марью, а смотрели вглубь – в себя – во что то счастливое и таинственное, совершающееся в ней.
– Marie, – сказала она, отстраняясь от пялец и переваливаясь назад, – дай сюда твою руку. – Она взяла руку княжны и наложила ее себе на живот.
Глаза ее улыбались ожидая, губка с усиками поднялась, и детски счастливо осталась поднятой.
Княжна Марья стала на колени перед ней, и спрятала лицо в складках платья невестки.
– Вот, вот – слышишь? Мне так странно. И знаешь, Мари, я очень буду любить его, – сказала Лиза, блестящими, счастливыми глазами глядя на золовку. Княжна Марья не могла поднять головы: она плакала.
– Что с тобой, Маша?
– Ничего… так мне грустно стало… грустно об Андрее, – сказала она, отирая слезы о колени невестки. Несколько раз, в продолжение утра, княжна Марья начинала приготавливать невестку, и всякий раз начинала плакать. Слезы эти, которых причину не понимала маленькая княгиня, встревожили ее, как ни мало она была наблюдательна. Она ничего не говорила, но беспокойно оглядывалась, отыскивая чего то. Перед обедом в ее комнату вошел старый князь, которого она всегда боялась, теперь с особенно неспокойным, злым лицом и, ни слова не сказав, вышел. Она посмотрела на княжну Марью, потом задумалась с тем выражением глаз устремленного внутрь себя внимания, которое бывает у беременных женщин, и вдруг заплакала.
– Получили от Андрея что нибудь? – сказала она.
– Нет, ты знаешь, что еще не могло притти известие, но mon реrе беспокоится, и мне страшно.
– Так ничего?
– Ничего, – сказала княжна Марья, лучистыми глазами твердо глядя на невестку. Она решилась не говорить ей и уговорила отца скрыть получение страшного известия от невестки до ее разрешения, которое должно было быть на днях. Княжна Марья и старый князь, каждый по своему, носили и скрывали свое горе. Старый князь не хотел надеяться: он решил, что князь Андрей убит, и не смотря на то, что он послал чиновника в Австрию розыскивать след сына, он заказал ему в Москве памятник, который намерен был поставить в своем саду, и всем говорил, что сын его убит. Он старался не изменяя вести прежний образ жизни, но силы изменяли ему: он меньше ходил, меньше ел, меньше спал, и с каждым днем делался слабее. Княжна Марья надеялась. Она молилась за брата, как за живого и каждую минуту ждала известия о его возвращении.
– Ma bonne amie, [Мой добрый друг,] – сказала маленькая княгиня утром 19 го марта после завтрака, и губка ее с усиками поднялась по старой привычке; но как и во всех не только улыбках, но звуках речей, даже походках в этом доме со дня получения страшного известия была печаль, то и теперь улыбка маленькой княгини, поддавшейся общему настроению, хотя и не знавшей его причины, – была такая, что она еще более напоминала об общей печали.
– Ma bonne amie, je crains que le fruschtique (comme dit Фока – повар) de ce matin ne m'aie pas fait du mal. [Дружочек, боюсь, чтоб от нынешнего фриштика (как называет его повар Фока) мне не было дурно.]
– А что с тобой, моя душа? Ты бледна. Ах, ты очень бледна, – испуганно сказала княжна Марья, своими тяжелыми, мягкими шагами подбегая к невестке.
– Ваше сиятельство, не послать ли за Марьей Богдановной? – сказала одна из бывших тут горничных. (Марья Богдановна была акушерка из уездного города, жившая в Лысых Горах уже другую неделю.)
– И в самом деле, – подхватила княжна Марья, – может быть, точно. Я пойду. Courage, mon ange! [Не бойся, мой ангел.] Она поцеловала Лизу и хотела выйти из комнаты.
– Ах, нет, нет! – И кроме бледности, на лице маленькой княгини выразился детский страх неотвратимого физического страдания.
– Non, c'est l'estomac… dites que c'est l'estomac, dites, Marie, dites…, [Нет это желудок… скажи, Маша, что это желудок…] – и княгиня заплакала детски страдальчески, капризно и даже несколько притворно, ломая свои маленькие ручки. Княжна выбежала из комнаты за Марьей Богдановной.
– Mon Dieu! Mon Dieu! [Боже мой! Боже мой!] Oh! – слышала она сзади себя.
Потирая полные, небольшие, белые руки, ей навстречу, с значительно спокойным лицом, уже шла акушерка.
– Марья Богдановна! Кажется началось, – сказала княжна Марья, испуганно раскрытыми глазами глядя на бабушку.
– Ну и слава Богу, княжна, – не прибавляя шага, сказала Марья Богдановна. – Вам девицам про это знать не следует.
– Но как же из Москвы доктор еще не приехал? – сказала княжна. (По желанию Лизы и князя Андрея к сроку было послано в Москву за акушером, и его ждали каждую минуту.)
– Ничего, княжна, не беспокойтесь, – сказала Марья Богдановна, – и без доктора всё хорошо будет.
Через пять минут княжна из своей комнаты услыхала, что несут что то тяжелое. Она выглянула – официанты несли для чего то в спальню кожаный диван, стоявший в кабинете князя Андрея. На лицах несших людей было что то торжественное и тихое.
Княжна Марья сидела одна в своей комнате, прислушиваясь к звукам дома, изредка отворяя дверь, когда проходили мимо, и приглядываясь к тому, что происходило в коридоре. Несколько женщин тихими шагами проходили туда и оттуда, оглядывались на княжну и отворачивались от нее. Она не смела спрашивать, затворяла дверь, возвращалась к себе, и то садилась в свое кресло, то бралась за молитвенник, то становилась на колена пред киотом. К несчастию и удивлению своему, она чувствовала, что молитва не утишала ее волнения. Вдруг дверь ее комнаты тихо отворилась и на пороге ее показалась повязанная платком ее старая няня Прасковья Савишна, почти никогда, вследствие запрещения князя,не входившая к ней в комнату.
– С тобой, Машенька, пришла посидеть, – сказала няня, – да вот княжовы свечи венчальные перед угодником зажечь принесла, мой ангел, – сказала она вздохнув.
– Ах как я рада, няня.
– Бог милостив, голубка. – Няня зажгла перед киотом обвитые золотом свечи и с чулком села у двери. Княжна Марья взяла книгу и стала читать. Только когда слышались шаги или голоса, княжна испуганно, вопросительно, а няня успокоительно смотрели друг на друга. Во всех концах дома было разлито и владело всеми то же чувство, которое испытывала княжна Марья, сидя в своей комнате. По поверью, что чем меньше людей знает о страданиях родильницы, тем меньше она страдает, все старались притвориться незнающими; никто не говорил об этом, но во всех людях, кроме обычной степенности и почтительности хороших манер, царствовавших в доме князя, видна была одна какая то общая забота, смягченность сердца и сознание чего то великого, непостижимого, совершающегося в эту минуту.
В большой девичьей не слышно было смеха. В официантской все люди сидели и молчали, на готове чего то. На дворне жгли лучины и свечи и не спали. Старый князь, ступая на пятку, ходил по кабинету и послал Тихона к Марье Богдановне спросить: что? – Только скажи: князь приказал спросить что? и приди скажи, что она скажет.
– Доложи князю, что роды начались, – сказала Марья Богдановна, значительно посмотрев на посланного. Тихон пошел и доложил князю.
– Хорошо, – сказал князь, затворяя за собою дверь, и Тихон не слыхал более ни малейшего звука в кабинете. Немного погодя, Тихон вошел в кабинет, как будто для того, чтобы поправить свечи. Увидав, что князь лежал на диване, Тихон посмотрел на князя, на его расстроенное лицо, покачал головой, молча приблизился к нему и, поцеловав его в плечо, вышел, не поправив свечей и не сказав, зачем он приходил. Таинство торжественнейшее в мире продолжало совершаться. Прошел вечер, наступила ночь. И чувство ожидания и смягчения сердечного перед непостижимым не падало, а возвышалось. Никто не спал.
Была одна из тех мартовских ночей, когда зима как будто хочет взять свое и высыпает с отчаянной злобой свои последние снега и бураны. Навстречу немца доктора из Москвы, которого ждали каждую минуту и за которым была выслана подстава на большую дорогу, к повороту на проселок, были высланы верховые с фонарями, чтобы проводить его по ухабам и зажорам.
Княжна Марья уже давно оставила книгу: она сидела молча, устремив лучистые глаза на сморщенное, до малейших подробностей знакомое, лицо няни: на прядку седых волос, выбившуюся из под платка, на висящий мешочек кожи под подбородком.
Няня Савишна, с чулком в руках, тихим голосом рассказывала, сама не слыша и не понимая своих слов, сотни раз рассказанное о том, как покойница княгиня в Кишиневе рожала княжну Марью, с крестьянской бабой молдаванкой, вместо бабушки.
– Бог помилует, никогда дохтура не нужны, – говорила она. Вдруг порыв ветра налег на одну из выставленных рам комнаты (по воле князя всегда с жаворонками выставлялось по одной раме в каждой комнате) и, отбив плохо задвинутую задвижку, затрепал штофной гардиной, и пахнув холодом, снегом, задул свечу. Княжна Марья вздрогнула; няня, положив чулок, подошла к окну и высунувшись стала ловить откинутую раму. Холодный ветер трепал концами ее платка и седыми, выбившимися прядями волос.
– Княжна, матушка, едут по прешпекту кто то! – сказала она, держа раму и не затворяя ее. – С фонарями, должно, дохтур…
– Ах Боже мой! Слава Богу! – сказала княжна Марья, – надо пойти встретить его: он не знает по русски.
Княжна Марья накинула шаль и побежала навстречу ехавшим. Когда она проходила переднюю, она в окно видела, что какой то экипаж и фонари стояли у подъезда. Она вышла на лестницу. На столбике перил стояла сальная свеча и текла от ветра. Официант Филипп, с испуганным лицом и с другой свечей в руке, стоял ниже, на первой площадке лестницы. Еще пониже, за поворотом, по лестнице, слышны были подвигавшиеся шаги в теплых сапогах. И какой то знакомый, как показалось княжне Марье, голос, говорил что то.
– Слава Богу! – сказал голос. – А батюшка?
– Почивать легли, – отвечал голос дворецкого Демьяна, бывшего уже внизу.
Потом еще что то сказал голос, что то ответил Демьян, и шаги в теплых сапогах стали быстрее приближаться по невидному повороту лестницы. «Это Андрей! – подумала княжна Марья. Нет, это не может быть, это было бы слишком необыкновенно», подумала она, и в ту же минуту, как она думала это, на площадке, на которой стоял официант со свечой, показались лицо и фигура князя Андрея в шубе с воротником, обсыпанным снегом. Да, это был он, но бледный и худой, и с измененным, странно смягченным, но тревожным выражением лица. Он вошел на лестницу и обнял сестру.
– Вы не получили моего письма? – спросил он, и не дожидаясь ответа, которого бы он и не получил, потому что княжна не могла говорить, он вернулся, и с акушером, который вошел вслед за ним (он съехался с ним на последней станции), быстрыми шагами опять вошел на лестницу и опять обнял сестру. – Какая судьба! – проговорил он, – Маша милая – и, скинув шубу и сапоги, пошел на половину княгини.
Маленькая княгиня лежала на подушках, в белом чепчике. (Страдания только что отпустили ее.) Черные волосы прядями вились у ее воспаленных, вспотевших щек; румяный, прелестный ротик с губкой, покрытой черными волосиками, был раскрыт, и она радостно улыбалась. Князь Андрей вошел в комнату и остановился перед ней, у изножья дивана, на котором она лежала. Блестящие глаза, смотревшие детски, испуганно и взволнованно, остановились на нем, не изменяя выражения. «Я вас всех люблю, я никому зла не делала, за что я страдаю? помогите мне», говорило ее выражение. Она видела мужа, но не понимала значения его появления теперь перед нею. Князь Андрей обошел диван и в лоб поцеловал ее.
– Душенька моя, – сказал он: слово, которое никогда не говорил ей. – Бог милостив. – Она вопросительно, детски укоризненно посмотрела на него.
– Я от тебя ждала помощи, и ничего, ничего, и ты тоже! – сказали ее глаза. Она не удивилась, что он приехал; она не поняла того, что он приехал. Его приезд не имел никакого отношения до ее страданий и облегчения их. Муки вновь начались, и Марья Богдановна посоветовала князю Андрею выйти из комнаты.
Акушер вошел в комнату. Князь Андрей вышел и, встретив княжну Марью, опять подошел к ней. Они шопотом заговорили, но всякую минуту разговор замолкал. Они ждали и прислушивались.
– Allez, mon ami, [Иди, мой друг,] – сказала княжна Марья. Князь Андрей опять пошел к жене, и в соседней комнате сел дожидаясь. Какая то женщина вышла из ее комнаты с испуганным лицом и смутилась, увидав князя Андрея. Он закрыл лицо руками и просидел так несколько минут. Жалкие, беспомощно животные стоны слышались из за двери. Князь Андрей встал, подошел к двери и хотел отворить ее. Дверь держал кто то.
– Нельзя, нельзя! – проговорил оттуда испуганный голос. – Он стал ходить по комнате. Крики замолкли, еще прошло несколько секунд. Вдруг страшный крик – не ее крик, она не могла так кричать, – раздался в соседней комнате. Князь Андрей подбежал к двери; крик замолк, послышался крик ребенка.
«Зачем принесли туда ребенка? подумал в первую секунду князь Андрей. Ребенок? Какой?… Зачем там ребенок? Или это родился ребенок?» Когда он вдруг понял всё радостное значение этого крика, слезы задушили его, и он, облокотившись обеими руками на подоконник, всхлипывая, заплакал, как плачут дети. Дверь отворилась. Доктор, с засученными рукавами рубашки, без сюртука, бледный и с трясущейся челюстью, вышел из комнаты. Князь Андрей обратился к нему, но доктор растерянно взглянул на него и, ни слова не сказав, прошел мимо. Женщина выбежала и, увидав князя Андрея, замялась на пороге. Он вошел в комнату жены. Она мертвая лежала в том же положении, в котором он видел ее пять минут тому назад, и то же выражение, несмотря на остановившиеся глаза и на бледность щек, было на этом прелестном, детском личике с губкой, покрытой черными волосиками.
«Я вас всех люблю и никому дурного не делала, и что вы со мной сделали?» говорило ее прелестное, жалкое, мертвое лицо. В углу комнаты хрюкнуло и пискнуло что то маленькое, красное в белых трясущихся руках Марьи Богдановны.
Через два часа после этого князь Андрей тихими шагами вошел в кабинет к отцу. Старик всё уже знал. Он стоял у самой двери, и, как только она отворилась, старик молча старческими, жесткими руками, как тисками, обхватил шею сына и зарыдал как ребенок.
Через три дня отпевали маленькую княгиню, и, прощаясь с нею, князь Андрей взошел на ступени гроба. И в гробу было то же лицо, хотя и с закрытыми глазами. «Ах, что вы со мной сделали?» всё говорило оно, и князь Андрей почувствовал, что в душе его оторвалось что то, что он виноват в вине, которую ему не поправить и не забыть. Он не мог плакать. Старик тоже вошел и поцеловал ее восковую ручку, спокойно и высоко лежащую на другой, и ему ее лицо сказало: «Ах, что и за что вы это со мной сделали?» И старик сердито отвернулся, увидав это лицо.
Еще через пять дней крестили молодого князя Николая Андреича. Мамушка подбородком придерживала пеленки, в то время, как гусиным перышком священник мазал сморщенные красные ладонки и ступеньки мальчика.
Крестный отец дед, боясь уронить, вздрагивая, носил младенца вокруг жестяной помятой купели и передавал его крестной матери, княжне Марье. Князь Андрей, замирая от страха, чтоб не утопили ребенка, сидел в другой комнате, ожидая окончания таинства. Он радостно взглянул на ребенка, когда ему вынесла его нянюшка, и одобрительно кивнул головой, когда нянюшка сообщила ему, что брошенный в купель вощечок с волосками не потонул, а поплыл по купели.
Участие Ростова в дуэли Долохова с Безуховым было замято стараниями старого графа, и Ростов вместо того, чтобы быть разжалованным, как он ожидал, был определен адъютантом к московскому генерал губернатору. Вследствие этого он не мог ехать в деревню со всем семейством, а оставался при своей новой должности всё лето в Москве. Долохов выздоровел, и Ростов особенно сдружился с ним в это время его выздоровления. Долохов больной лежал у матери, страстно и нежно любившей его. Старушка Марья Ивановна, полюбившая Ростова за его дружбу к Феде, часто говорила ему про своего сына.
– Да, граф, он слишком благороден и чист душою, – говаривала она, – для нашего нынешнего, развращенного света. Добродетели никто не любит, она всем глаза колет. Ну скажите, граф, справедливо это, честно это со стороны Безухова? А Федя по своему благородству любил его, и теперь никогда ничего дурного про него не говорит. В Петербурге эти шалости с квартальным там что то шутили, ведь они вместе делали? Что ж, Безухову ничего, а Федя все на своих плечах перенес! Ведь что он перенес! Положим, возвратили, да ведь как же и не возвратить? Я думаю таких, как он, храбрецов и сынов отечества не много там было. Что ж теперь – эта дуэль! Есть ли чувство, честь у этих людей! Зная, что он единственный сын, вызвать на дуэль и стрелять так прямо! Хорошо, что Бог помиловал нас. И за что же? Ну кто же в наше время не имеет интриги? Что ж, коли он так ревнив? Я понимаю, ведь он прежде мог дать почувствовать, а то год ведь продолжалось. И что же, вызвал на дуэль, полагая, что Федя не будет драться, потому что он ему должен. Какая низость! Какая гадость! Я знаю, вы Федю поняли, мой милый граф, оттого то я вас душой люблю, верьте мне. Его редкие понимают. Это такая высокая, небесная душа!
Сам Долохов часто во время своего выздоровления говорил Ростову такие слова, которых никак нельзя было ожидать от него. – Меня считают злым человеком, я знаю, – говаривал он, – и пускай. Я никого знать не хочу кроме тех, кого люблю; но кого я люблю, того люблю так, что жизнь отдам, а остальных передавлю всех, коли станут на дороге. У меня есть обожаемая, неоцененная мать, два три друга, ты в том числе, а на остальных я обращаю внимание только на столько, на сколько они полезны или вредны. И все почти вредны, в особенности женщины. Да, душа моя, – продолжал он, – мужчин я встречал любящих, благородных, возвышенных; но женщин, кроме продажных тварей – графинь или кухарок, всё равно – я не встречал еще. Я не встречал еще той небесной чистоты, преданности, которых я ищу в женщине. Ежели бы я нашел такую женщину, я бы жизнь отдал за нее. А эти!… – Он сделал презрительный жест. – И веришь ли мне, ежели я еще дорожу жизнью, то дорожу только потому, что надеюсь еще встретить такое небесное существо, которое бы возродило, очистило и возвысило меня. Но ты не понимаешь этого.
– Нет, я очень понимаю, – отвечал Ростов, находившийся под влиянием своего нового друга.
Осенью семейство Ростовых вернулось в Москву. В начале зимы вернулся и Денисов и остановился у Ростовых. Это первое время зимы 1806 года, проведенное Николаем Ростовым в Москве, было одно из самых счастливых и веселых для него и для всего его семейства. Николай привлек с собой в дом родителей много молодых людей. Вера была двадцати летняя, красивая девица; Соня шестнадцати летняя девушка во всей прелести только что распустившегося цветка; Наташа полу барышня, полу девочка, то детски смешная, то девически обворожительная.
В доме Ростовых завелась в это время какая то особенная атмосфера любовности, как это бывает в доме, где очень милые и очень молодые девушки. Всякий молодой человек, приезжавший в дом Ростовых, глядя на эти молодые, восприимчивые, чему то (вероятно своему счастию) улыбающиеся, девические лица, на эту оживленную беготню, слушая этот непоследовательный, но ласковый ко всем, на всё готовый, исполненный надежды лепет женской молодежи, слушая эти непоследовательные звуки, то пенья, то музыки, испытывал одно и то же чувство готовности к любви и ожидания счастья, которое испытывала и сама молодежь дома Ростовых.
В числе молодых людей, введенных Ростовым, был одним из первых – Долохов, который понравился всем в доме, исключая Наташи. За Долохова она чуть не поссорилась с братом. Она настаивала на том, что он злой человек, что в дуэли с Безуховым Пьер был прав, а Долохов виноват, что он неприятен и неестествен.
– Нечего мне понимать, – с упорным своевольством кричала Наташа, – он злой и без чувств. Вот ведь я же люблю твоего Денисова, он и кутила, и всё, а я всё таки его люблю, стало быть я понимаю. Не умею, как тебе сказать; у него всё назначено, а я этого не люблю. Денисова…
– Ну Денисов другое дело, – отвечал Николай, давая чувствовать, что в сравнении с Долоховым даже и Денисов был ничто, – надо понимать, какая душа у этого Долохова, надо видеть его с матерью, это такое сердце!
– Уж этого я не знаю, но с ним мне неловко. И ты знаешь ли, что он влюбился в Соню?
– Какие глупости…
– Я уверена, вот увидишь. – Предсказание Наташи сбывалось. Долохов, не любивший дамского общества, стал часто бывать в доме, и вопрос о том, для кого он ездит, скоро (хотя и никто не говорил про это) был решен так, что он ездит для Сони. И Соня, хотя никогда не посмела бы сказать этого, знала это и всякий раз, как кумач, краснела при появлении Долохова.
Долохов часто обедал у Ростовых, никогда не пропускал спектакля, где они были, и бывал на балах adolescentes [подростков] у Иогеля, где всегда бывали Ростовы. Он оказывал преимущественное внимание Соне и смотрел на нее такими глазами, что не только она без краски не могла выдержать этого взгляда, но и старая графиня и Наташа краснели, заметив этот взгляд.
Видно было, что этот сильный, странный мужчина находился под неотразимым влиянием, производимым на него этой черненькой, грациозной, любящей другого девочкой.
Ростов замечал что то новое между Долоховым и Соней; но он не определял себе, какие это были новые отношения. «Они там все влюблены в кого то», думал он про Соню и Наташу. Но ему было не так, как прежде, ловко с Соней и Долоховым, и он реже стал бывать дома.
С осени 1806 года опять всё заговорило о войне с Наполеоном еще с большим жаром, чем в прошлом году. Назначен был не только набор рекрут, но и еще 9 ти ратников с тысячи. Повсюду проклинали анафемой Бонапартия, и в Москве только и толков было, что о предстоящей войне. Для семейства Ростовых весь интерес этих приготовлений к войне заключался только в том, что Николушка ни за что не соглашался оставаться в Москве и выжидал только конца отпуска Денисова с тем, чтобы с ним вместе ехать в полк после праздников. Предстоящий отъезд не только не мешал ему веселиться, но еще поощрял его к этому. Большую часть времени он проводил вне дома, на обедах, вечерах и балах.
ХI
На третий день Рождества, Николай обедал дома, что в последнее время редко случалось с ним. Это был официально прощальный обед, так как он с Денисовым уезжал в полк после Крещенья. Обедало человек двадцать, в том числе Долохов и Денисов.
Никогда в доме Ростовых любовный воздух, атмосфера влюбленности не давали себя чувствовать с такой силой, как в эти дни праздников. «Лови минуты счастия, заставляй себя любить, влюбляйся сам! Только это одно есть настоящее на свете – остальное всё вздор. И этим одним мы здесь только и заняты», – говорила эта атмосфера. Николай, как и всегда, замучив две пары лошадей и то не успев побывать во всех местах, где ему надо было быть и куда его звали, приехал домой перед самым обедом. Как только он вошел, он заметил и почувствовал напряженность любовной атмосферы в доме, но кроме того он заметил странное замешательство, царствующее между некоторыми из членов общества. Особенно взволнованы были Соня, Долохов, старая графиня и немного Наташа. Николай понял, что что то должно было случиться до обеда между Соней и Долоховым и с свойственною ему чуткостью сердца был очень нежен и осторожен, во время обеда, в обращении с ними обоими. В этот же вечер третьего дня праздников должен был быть один из тех балов у Иогеля (танцовального учителя), которые он давал по праздникам для всех своих учеников и учениц.
– Николенька, ты поедешь к Иогелю? Пожалуйста, поезжай, – сказала ему Наташа, – он тебя особенно просил, и Василий Дмитрич (это был Денисов) едет.
– Куда я не поеду по приказанию г'афини! – сказал Денисов, шутливо поставивший себя в доме Ростовых на ногу рыцаря Наташи, – pas de chale [танец с шалью] готов танцовать.
– Коли успею! Я обещал Архаровым, у них вечер, – сказал Николай.
– А ты?… – обратился он к Долохову. И только что спросил это, заметил, что этого не надо было спрашивать.
– Да, может быть… – холодно и сердито отвечал Долохов, взглянув на Соню и, нахмурившись, точно таким взглядом, каким он на клубном обеде смотрел на Пьера, опять взглянул на Николая.
«Что нибудь есть», подумал Николай и еще более утвердился в этом предположении тем, что Долохов тотчас же после обеда уехал. Он вызвал Наташу и спросил, что такое?
– А я тебя искала, – сказала Наташа, выбежав к нему. – Я говорила, ты всё не хотел верить, – торжествующе сказала она, – он сделал предложение Соне.
Как ни мало занимался Николай Соней за это время, но что то как бы оторвалось в нем, когда он услыхал это. Долохов был приличная и в некоторых отношениях блестящая партия для бесприданной сироты Сони. С точки зрения старой графини и света нельзя было отказать ему. И потому первое чувство Николая, когда он услыхал это, было озлобление против Сони. Он приготавливался к тому, чтобы сказать: «И прекрасно, разумеется, надо забыть детские обещания и принять предложение»; но не успел он еще сказать этого…
– Можешь себе представить! она отказала, совсем отказала! – заговорила Наташа. – Она сказала, что любит другого, – прибавила она, помолчав немного.
«Да иначе и не могла поступить моя Соня!» подумал Николай.
– Сколько ее ни просила мама, она отказала, и я знаю, она не переменит, если что сказала…
– А мама просила ее! – с упреком сказал Николай.
– Да, – сказала Наташа. – Знаешь, Николенька, не сердись; но я знаю, что ты на ней не женишься. Я знаю, Бог знает отчего, я знаю верно, ты не женишься.
– Ну, этого ты никак не знаешь, – сказал Николай; – но мне надо поговорить с ней. Что за прелесть, эта Соня! – прибавил он улыбаясь.
– Это такая прелесть! Я тебе пришлю ее. – И Наташа, поцеловав брата, убежала.
Через минуту вошла Соня, испуганная, растерянная и виноватая. Николай подошел к ней и поцеловал ее руку. Это был первый раз, что они в этот приезд говорили с глазу на глаз и о своей любви.
– Sophie, – сказал он сначала робко, и потом всё смелее и смелее, – ежели вы хотите отказаться не только от блестящей, от выгодной партии; но он прекрасный, благородный человек… он мой друг…
Соня перебила его.
– Я уж отказалась, – сказала она поспешно.
– Ежели вы отказываетесь для меня, то я боюсь, что на мне…
Соня опять перебила его. Она умоляющим, испуганным взглядом посмотрела на него.
– Nicolas, не говорите мне этого, – сказала она.
– Нет, я должен. Может быть это suffisance [самонадеянность] с моей стороны, но всё лучше сказать. Ежели вы откажетесь для меня, то я должен вам сказать всю правду. Я вас люблю, я думаю, больше всех…
– Мне и довольно, – вспыхнув, сказала Соня.
– Нет, но я тысячу раз влюблялся и буду влюбляться, хотя такого чувства дружбы, доверия, любви, я ни к кому не имею, как к вам. Потом я молод. Мaman не хочет этого. Ну, просто, я ничего не обещаю. И я прошу вас подумать о предложении Долохова, – сказал он, с трудом выговаривая фамилию своего друга.
– Не говорите мне этого. Я ничего не хочу. Я люблю вас, как брата, и всегда буду любить, и больше мне ничего не надо.
– Вы ангел, я вас не стою, но я только боюсь обмануть вас. – Николай еще раз поцеловал ее руку.
У Иогеля были самые веселые балы в Москве. Это говорили матушки, глядя на своих adolescentes, [девушек,] выделывающих свои только что выученные па; это говорили и сами adolescentes и adolescents, [девушки и юноши,] танцовавшие до упаду; эти взрослые девицы и молодые люди, приезжавшие на эти балы с мыслию снизойти до них и находя в них самое лучшее веселье. В этот же год на этих балах сделалось два брака. Две хорошенькие княжны Горчаковы нашли женихов и вышли замуж, и тем еще более пустили в славу эти балы. Особенного на этих балах было то, что не было хозяина и хозяйки: был, как пух летающий, по правилам искусства расшаркивающийся, добродушный Иогель, который принимал билетики за уроки от всех своих гостей; было то, что на эти балы еще езжали только те, кто хотел танцовать и веселиться, как хотят этого 13 ти и 14 ти летние девочки, в первый раз надевающие длинные платья. Все, за редкими исключениями, были или казались хорошенькими: так восторженно они все улыбались и так разгорались их глазки. Иногда танцовывали даже pas de chale лучшие ученицы, из которых лучшая была Наташа, отличавшаяся своею грациозностью; но на этом, последнем бале танцовали только экосезы, англезы и только что входящую в моду мазурку. Зала была взята Иогелем в дом Безухова, и бал очень удался, как говорили все. Много было хорошеньких девочек, и Ростовы барышни были из лучших. Они обе были особенно счастливы и веселы. В этот вечер Соня, гордая предложением Долохова, своим отказом и объяснением с Николаем, кружилась еще дома, не давая девушке дочесать свои косы, и теперь насквозь светилась порывистой радостью.
Наташа, не менее гордая тем, что она в первый раз была в длинном платье, на настоящем бале, была еще счастливее. Обе были в белых, кисейных платьях с розовыми лентами.
Наташа сделалась влюблена с самой той минуты, как она вошла на бал. Она не была влюблена ни в кого в особенности, но влюблена была во всех. В того, на кого она смотрела в ту минуту, как она смотрела, в того она и была влюблена.
– Ах, как хорошо! – всё говорила она, подбегая к Соне.
Николай с Денисовым ходили по залам, ласково и покровительственно оглядывая танцующих.
– Как она мила, к'асавица будет, – сказал Денисов.
– Кто?
– Г'афиня Наташа, – отвечал Денисов.
– И как она танцует, какая г'ация! – помолчав немного, опять сказал он.
– Да про кого ты говоришь?
– Про сест'у п'о твою, – сердито крикнул Денисов.
Ростов усмехнулся.
– Mon cher comte; vous etes l'un de mes meilleurs ecoliers, il faut que vous dansiez, – сказал маленький Иогель, подходя к Николаю. – Voyez combien de jolies demoiselles. [Любезный граф, вы один из лучших моих учеников. Вам надо танцовать. Посмотрите, сколько хорошеньких девушек!] – Он с тою же просьбой обратился и к Денисову, тоже своему бывшему ученику.
– Non, mon cher, je fe'ai tapisse'ie, [Нет, мой милый, я посижу у стенки,] – сказал Денисов. – Разве вы не помните, как дурно я пользовался вашими уроками?
– О нет! – поспешно утешая его, сказал Иогель. – Вы только невнимательны были, а вы имели способности, да, вы имели способности.
Заиграли вновь вводившуюся мазурку; Николай не мог отказать Иогелю и пригласил Соню. Денисов подсел к старушкам и облокотившись на саблю, притопывая такт, что то весело рассказывал и смешил старых дам, поглядывая на танцующую молодежь. Иогель в первой паре танцовал с Наташей, своей гордостью и лучшей ученицей. Мягко, нежно перебирая своими ножками в башмачках, Иогель первым полетел по зале с робевшей, но старательно выделывающей па Наташей. Денисов не спускал с нее глаз и пристукивал саблей такт, с таким видом, который ясно говорил, что он сам не танцует только от того, что не хочет, а не от того, что не может. В середине фигуры он подозвал к себе проходившего мимо Ростова.
– Это совсем не то, – сказал он. – Разве это польская мазу'ка? А отлично танцует. – Зная, что Денисов и в Польше даже славился своим мастерством плясать польскую мазурку, Николай подбежал к Наташе:
– Поди, выбери Денисова. Вот танцует! Чудо! – сказал он.
Когда пришел опять черед Наташе, она встала и быстро перебирая своими с бантиками башмачками, робея, одна пробежала через залу к углу, где сидел Денисов. Она видела, что все смотрят на нее и ждут. Николай видел, что Денисов и Наташа улыбаясь спорили, и что Денисов отказывался, но радостно улыбался. Он подбежал.
– Пожалуйста, Василий Дмитрич, – говорила Наташа, – пойдемте, пожалуйста.
– Да, что, увольте, г'афиня, – говорил Денисов.
– Ну, полно, Вася, – сказал Николай.
– Точно кота Ваську угова'ивают, – шутя сказал Денисов.
– Целый вечер вам буду петь, – сказала Наташа.
– Волшебница всё со мной сделает! – сказал Денисов и отстегнул саблю. Он вышел из за стульев, крепко взял за руку свою даму, приподнял голову и отставил ногу, ожидая такта. Только на коне и в мазурке не видно было маленького роста Денисова, и он представлялся тем самым молодцом, каким он сам себя чувствовал. Выждав такт, он с боку, победоносно и шутливо, взглянул на свою даму, неожиданно пристукнул одной ногой и, как мячик, упруго отскочил от пола и полетел вдоль по кругу, увлекая за собой свою даму. Он не слышно летел половину залы на одной ноге, и, казалось, не видел стоявших перед ним стульев и прямо несся на них; но вдруг, прищелкнув шпорами и расставив ноги, останавливался на каблуках, стоял так секунду, с грохотом шпор стучал на одном месте ногами, быстро вертелся и, левой ногой подщелкивая правую, опять летел по кругу. Наташа угадывала то, что он намерен был сделать, и, сама не зная как, следила за ним – отдаваясь ему. То он кружил ее, то на правой, то на левой руке, то падая на колена, обводил ее вокруг себя, и опять вскакивал и пускался вперед с такой стремительностью, как будто он намерен был, не переводя духа, перебежать через все комнаты; то вдруг опять останавливался и делал опять новое и неожиданное колено. Когда он, бойко закружив даму перед ее местом, щелкнул шпорой, кланяясь перед ней, Наташа даже не присела ему. Она с недоуменьем уставила на него глаза, улыбаясь, как будто не узнавая его. – Что ж это такое? – проговорила она.
Несмотря на то, что Иогель не признавал эту мазурку настоящей, все были восхищены мастерством Денисова, беспрестанно стали выбирать его, и старики, улыбаясь, стали разговаривать про Польшу и про доброе старое время. Денисов, раскрасневшись от мазурки и отираясь платком, подсел к Наташе и весь бал не отходил от нее.
Два дня после этого, Ростов не видал Долохова у своих и не заставал его дома; на третий день он получил от него записку. «Так как я в доме у вас бывать более не намерен по известным тебе причинам и еду в армию, то нынче вечером я даю моим приятелям прощальную пирушку – приезжай в английскую гостинницу». Ростов в 10 м часу, из театра, где он был вместе с своими и Денисовым, приехал в назначенный день в английскую гостинницу. Его тотчас же провели в лучшее помещение гостинницы, занятое на эту ночь Долоховым. Человек двадцать толпилось около стола, перед которым между двумя свечами сидел Долохов. На столе лежало золото и ассигнации, и Долохов метал банк. После предложения и отказа Сони, Николай еще не видался с ним и испытывал замешательство при мысли о том, как они свидятся.


