Азотистая кислота
| Азотистая кислота | |
| |
| Trans-nitrous-acid-3D-balls.png | |
| Общие | |
|---|---|
| Систематическое наименование |
Азотистая кислота
|
| Хим. формула | HNO2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 47.0134 г/моль |
| Плотность | 1.685 (жидк) |
| Термические свойства | |
| Т. плав. | 42.35 °C |
| Т. кип. | 158 °C |
| Химические свойства | |
| pKa | 3.4 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7782-77-6] |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Содержание
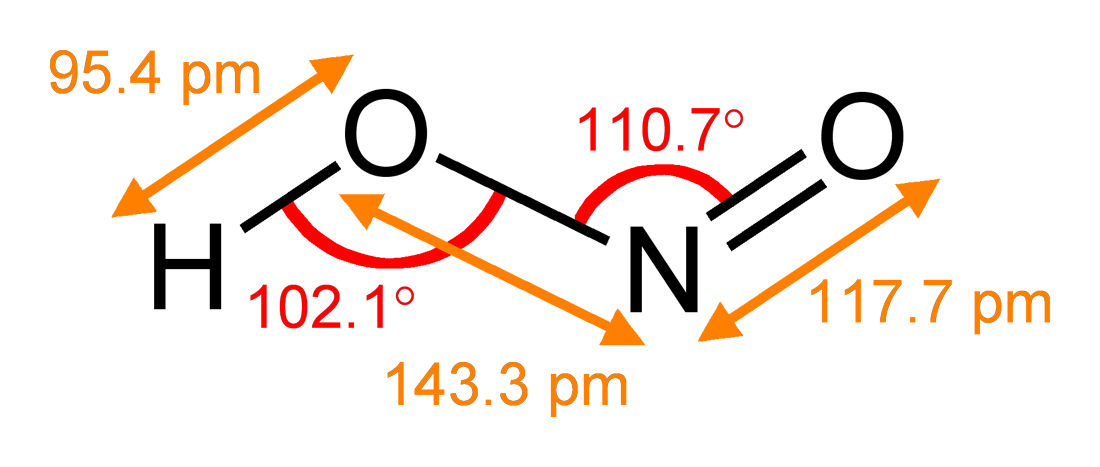
Строение
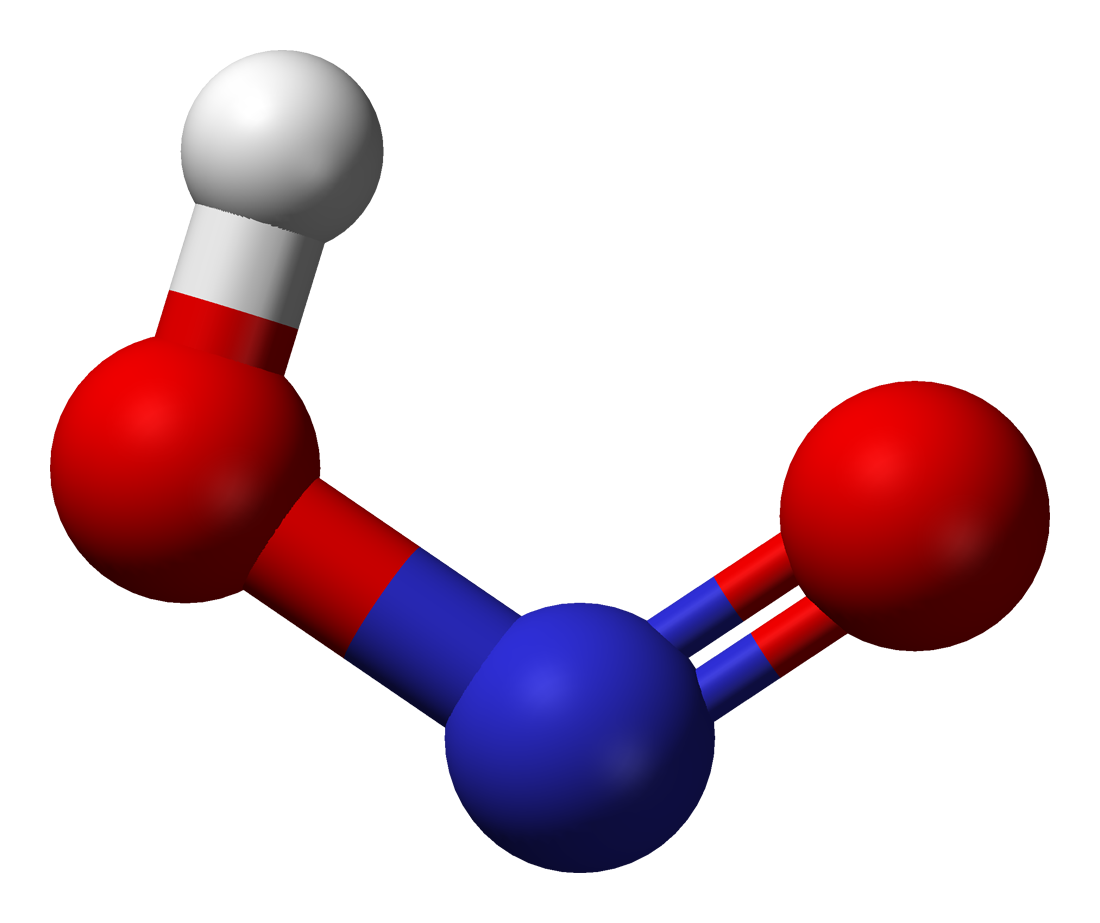
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-.
 |
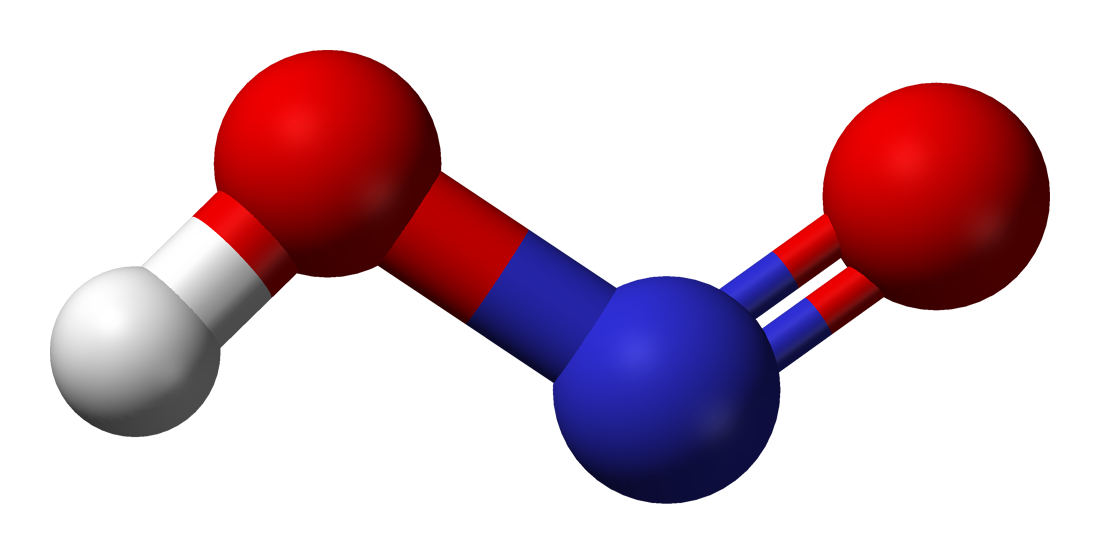 |
При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO2(г) DG°f = −42,59 кДж/моль, а для транс-HNO2(г) DG = −44,65 кДж/моль.
Химические свойства
В водных растворах существует равновесие:
- <math>\mathsf{2HNO_2 \rightleftarrows N_2O_3 + H_2O \rightleftarrows NO \uparrow + NO_2 \uparrow + H_2O}</math>
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
- <math>\mathsf{3HNO_2 \rightleftarrows HNO_3 + 2NO \uparrow + H_2O}</math>
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
- <math>\mathsf{H_2SO_4 + 2NaNO_2 \rightarrow Na_2SO_4 + 2HNO_2}</math>
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
- <math>\mathsf{HNO_2 + H_2O_2 \rightarrow HNO_3 + H_2O}</math>
- <math>\mathsf{HNO_2 + Cl_2 + H_2O\rightarrow HNO_3 + 2HCl}</math>
- <math>\mathsf{5HNO_2 + 2KMnO_4 + HNO_3 \rightarrow 2Mn(NO_3)_2 + 2KNO_3 + 3H_2O}</math>
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
- <math>
\mathsf{2HNO_2 + 2HI \rightarrow 2NO\uparrow + I_2 +2H_2O}</math>
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
- <math>\mathsf{N_2O_3 + H_2O \rightarrow 2HNO_2}</math>
Также она получается при растворении в воде оксида азота (IV) NO2:
- <math>\mathsf{2NO_2 + H_2O \rightarrow HNO_3 + HNO_2}</math>
Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
Физиологическое действие
Азотистая кислота токсична, причём обладает ярко выраженным мутагенным действием, поскольку является деаминирующим агентом.
Источники
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Напишите отзыв о статье "Азотистая кислота"
Ссылки
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
| |
Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
Отрывок, характеризующий Азотистая кислота
Соня, как бы не веря своим ушам, смотрела во все глаза на Наташу.– А Болконский? – сказала она.
– Ах, Соня, ах коли бы ты могла знать, как я счастлива! – сказала Наташа. – Ты не знаешь, что такое любовь…
– Но, Наташа, неужели то всё кончено?
Наташа большими, открытыми глазами смотрела на Соню, как будто не понимая ее вопроса.
– Что ж, ты отказываешь князю Андрею? – сказала Соня.
– Ах, ты ничего не понимаешь, ты не говори глупости, ты слушай, – с мгновенной досадой сказала Наташа.
– Нет, я не могу этому верить, – повторила Соня. – Я не понимаю. Как же ты год целый любила одного человека и вдруг… Ведь ты только три раза видела его. Наташа, я тебе не верю, ты шалишь. В три дня забыть всё и так…
– Три дня, – сказала Наташа. – Мне кажется, я сто лет люблю его. Мне кажется, что я никого никогда не любила прежде его. Ты этого не можешь понять. Соня, постой, садись тут. – Наташа обняла и поцеловала ее.
– Мне говорили, что это бывает и ты верно слышала, но я теперь только испытала эту любовь. Это не то, что прежде. Как только я увидала его, я почувствовала, что он мой властелин, и я раба его, и что я не могу не любить его. Да, раба! Что он мне велит, то я и сделаю. Ты не понимаешь этого. Что ж мне делать? Что ж мне делать, Соня? – говорила Наташа с счастливым и испуганным лицом.
– Но ты подумай, что ты делаешь, – говорила Соня, – я не могу этого так оставить. Эти тайные письма… Как ты могла его допустить до этого? – говорила она с ужасом и с отвращением, которое она с трудом скрывала.
– Я тебе говорила, – отвечала Наташа, – что у меня нет воли, как ты не понимаешь этого: я его люблю!
– Так я не допущу до этого, я расскажу, – с прорвавшимися слезами вскрикнула Соня.
– Что ты, ради Бога… Ежели ты расскажешь, ты мой враг, – заговорила Наташа. – Ты хочешь моего несчастия, ты хочешь, чтоб нас разлучили…
Увидав этот страх Наташи, Соня заплакала слезами стыда и жалости за свою подругу.
– Но что было между вами? – спросила она. – Что он говорил тебе? Зачем он не ездит в дом?
Наташа не отвечала на ее вопрос.
– Ради Бога, Соня, никому не говори, не мучай меня, – упрашивала Наташа. – Ты помни, что нельзя вмешиваться в такие дела. Я тебе открыла…
– Но зачем эти тайны! Отчего же он не ездит в дом? – спрашивала Соня. – Отчего он прямо не ищет твоей руки? Ведь князь Андрей дал тебе полную свободу, ежели уж так; но я не верю этому. Наташа, ты подумала, какие могут быть тайные причины ?
Наташа удивленными глазами смотрела на Соню. Видно, ей самой в первый раз представлялся этот вопрос и она не знала, что отвечать на него.
– Какие причины, не знаю. Но стало быть есть причины!
Соня вздохнула и недоверчиво покачала головой.
– Ежели бы были причины… – начала она. Но Наташа угадывая ее сомнение, испуганно перебила ее.
– Соня, нельзя сомневаться в нем, нельзя, нельзя, ты понимаешь ли? – прокричала она.
– Любит ли он тебя?
– Любит ли? – повторила Наташа с улыбкой сожаления о непонятливости своей подруги. – Ведь ты прочла письмо, ты видела его?
– Но если он неблагородный человек?
– Он!… неблагородный человек? Коли бы ты знала! – говорила Наташа.
