8-Оксо-2′-дезоксигуанозин
| 8-Оксо-2′-дезоксигуанозин | |
| Общие | |
|---|---|
| Систематическое наименование |
2-амино-9-[(2R,4S,5R)-4-гидрокси-5-(гидроксиметил)оксолан-2-ил]-3,7-дигидропурин-6,8-дион
|
| Сокращения | 8-оксо-dG |
| Хим. формула | C10H13N5O5 |
| Физические свойства | |
| Молярная масса | 283.24 г/моль |
| Классификация | |
| Рег. номер CAS | 88847-89-6 |
| PubChem | |
| ChEBI | CHEBI:40304 |
| ChemSpider | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
8-оксо-2'-дезоксигуанозин (8-оксо-dG) — окисленное производное дезоксигуанозина. 8-оксо-dG является преобладающей формой свободнорадикального повреждения ДНК.
Содержание
8-оксо-2'-дезоксигуанозин и ДНК
ДНК в живых системах постоянно подвергается действию активных форм кислорода,таких как супероксиданион-радикал (O2-), перекись водорода (H2O2) и высокореактивный гидроксил-радикал (OH·). Гуанин обладает самым низким потенциалом ионизации среди природных азотистых оснований, поэтому наиболее подвержен окислительному повреждению[1]. Образование 8-оксо-2’-дезоксигуанозина в результате реакции 2’-оксигуанозина с гидроксилрадикалами изображено на рисунке внизу.
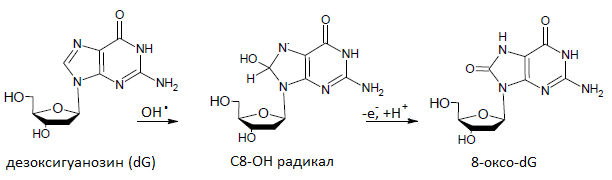 8-Оxo-dG составляет около 5% от общего
числа окисленных оснований, которые обнаружены в ДНК[2].
8-Оxo-dG составляет около 5% от общего
числа окисленных оснований, которые обнаружены в ДНК[2].
8-оксо-2'-дезоксигуанозин как биомаркер окислительного стресса
К настоящему времени участие активных форм кислорода (АФК) показано для более чем 200 заболеваний и патологических состояний. Можно сказать, что устойчивое состояние окислительного повреждения ДНК у человека является биологическим маркером, предсказывающим (в некоторой степени) возможность развития некоторого заболевания в будущем[3]. Существует ряд причин, обосновывающих выбор 8-оксо-dG в качестве такого биомаркера:
- Он образуется с помощью нескольких форм АФК, таких как синглетный кислород и гидроксильный радикал.
- Установлено мутагенное действие 8-оксо-dG, вызванное возможными трансверсиями GC-TA.
- Наличие сложных механизмов, которые развились в процессе эволюции для удаления 8-оксо-dG и для предотвращения его включения в ДНК, которое позволяет предположить, что клетка воспринимает его в качестве угрозы, которую нужно быстро устранять [4].
- Доступность чувствительных методов его детекции.
Кроме того, 8-оксо-dG можно использовать в качестве маркера для определения наиболее эффективной дозы облучения при лечении раковых заболеваний. У пациентов, имеющих острую радиочувствительность, содержание 8-оксо-dG в моче выше, чем у тех, чей ответ на облучение был умеренным [5].
В настоящее время накоплено большое число свидетельств в пользу развития окислительного стресса при психоневрологических расстройствах, таких как болезнь Альцгеймера, болезнь Паркинсона, инсульты, склерозы, неврозы.[6] Известно, что у пациентов с прогрессирующей болезнью Паркинсона уровень секретируемого в мочу 8-оксо-dG возрастал по сравнению со здоровыми людьми. Таким образом, 8-оксо-dG можно использовать в качестве маркера, который показывает степень развития заболевания.[7] Кроме того, повышение уровня 8-оксо-dG в моче и лейкоцитарной ДНК отмечалось также у пациентов с диабетом, при этом есть корреляция между уровнем окислительного повреждения ДНК и тяжестью диабетической нефропатии и ретинопатии.[8]
8-оксо-2'-дезоксигуанозин и его роль в процессах старения
Как известно, активные формы кислорода (АФК) постоянно образуются в живых клетках, вызывая окислительные повреждения различных внутриклеточных макромолекул. Радикальная теория старения была впервые выдвинута Харманом еще в 1956[9], и с тех пор проводятся многочисленные исследования АФК-зависимого старения. Поскольку одним из часто встречающихся окислительных повреждений ДНК является 8-оксо-2’-дезоксигуанозин, можно предположить, что существует связь между накоплением такого модифицированного нуклеотида в ДНК и процессами старения.
Зависимое от возраста накопление 8-оксо-dG в ДНК было обнаружено у млекопитающих в различных органах и тканях[10]. Кроме того, повышение с возрастом уровня 8-оксо-dG наблюдалось как в ядерной, так и в митохондриальной ДНК у мышей и крыс. Ограничение калорийности питания, которое известно как способ замедления старения и повышения продолжительности жизни у грызунов, показало значительное снижение зависимого от возраста накопления 8-оксо-dG во всех тканях мышей линии B6D23F1 и некоторых тканей линии F344 для ядерной ДНК. Также было показано, что ограничение калорийности питания препятствует накоплению 8-оксо-dG с возрастом и в митохондриальной ДНК у крыс и мышей[11].
8-оксо-2’-дезоксигуанозин и карциногенез
Карциногенез является сложным процессом, состоящим из трех стадий: инициации, продвижения и прогрессии, приводящих к образованию злокачественных опухолей[12]. При избытке АФК окислительное повреждение ДНК приводит к мутациям, хромосомным перестройкам, обмену сестринскими хроматидами и т.д., а кроме того может влиять на модуляцию экспрессии генов путём эпигенетических модификаций. Эти процессы играют ключевую роль в карциногенезе на стадии продвижения, когда подключаются гены, регулирующие клеточную дифференцировку и рост.
Такая эпигенетическая модификация, как метилирование CpG-островков в промоторных областях генов, может репрессировать экспрессию генов. В исследовании Nishida et al[13] было показано, что среди пяти оцененных факторов повышенный уровень именно 8-оксо-dG хорошо коррелировал с метилированием промоторов генов супрессоров опухолевого роста. (pvalue<0.0001). Таким образом, метилирование данных промоторов уменьшает экспрессию генов супрессоров и способствует карциногенезу.
Ссылки
- ↑ Verhagen H., Poulsen H.E., Loft S. Reduction of oxidative DNA-damage in humans by Brussels sprouts // Carcinogenesis.— 1995.— Vol.16.— P.969–970. PMID [www.ncbi.nlm.nih.gov/pubmed/7728983 7728983]
- ↑ Dizdaroglu M. Oxidative damage to DNA in mammalian chromatin // Mutat. Res.— 1992.— V.275.— P.331–342. PMID [www.ncbi.nlm.nih.gov/pubmed/1383774 1383774]
- ↑ Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс. Патологические состояния и заболевания. // АРТА.— 2008.— с.284
- ↑ Gordon AJ, Satory D, Wang M, Halliday JA, Golding I, Herman C. Removal of 8-oxo-GTP by MutT hydrolase is not a major contributor to transcriptional fidelity // Nucleic Acids Res.— 2014.— Vol.42(19).— P.12015-26. DOI:10.1093/nar/gku912 PMID [www.ncbi.nlm.nih.gov/pubmed/25294823 25294823]
- ↑ Haghdoost S., Svoboda P., Naslud I., Harms-Ringdahl M., Tilikides A., Skog S. Can 8-oxo-dG be used as a predictor for individual radiosensitivity? // Int. J. Radiat. Oncol. Biol. Phys.— 2001.— Vol.50.— P.405–410. PMID [www.ncbi.nlm.nih.gov/pubmed/11380227 11380227]
- ↑ Dorszewska J., Florczak J., Rozycka A., Kempisty B., Jaroszewska-Kolecka J., Chojnacka K., Trzeciak W.H., Kozubski W. Oxidative DNA damage and level of thiols as related to polymorphisms of MTHFR, MTR, MTHFD1 in Alzheimer's and Parkinson's diseases // Acta Neurobiol. Exp. (Wars).— 2007.— Vol.67.— P.113–129. PMID [www.ncbi.nlm.nih.gov/pubmed/17691219 17691219]
- ↑ Sato S., Mizuno Y., Hattori N. Urinary 8-hydroxydeoxyguanosine levels as a biomarker for progression of Parkinson disease // J. Neurology.— 2005.— Vol.64.— P.1081–1083. PMID [www.ncbi.nlm.nih.gov/pubmed/15781836 15781836]
- ↑ Wua L.L., Chioud C.-C., Change Pi-Yueh, Wua J.T. Urinary 8-OH-dG: А marker of oxidative stress to DNA and a risk factor for cancer, atherosclerosis and diabetics // J. Clin. Chim. Acta.— 2004.— Vol.339.— P. 1–9. PMID [www.ncbi.nlm.nih.gov/pubmed/14687888 14687888]
- ↑ Harman D. Aging: a theory based on free radical and radiation chemistry // Journal of Gerontology.— 1956.— Vol.11(3).— P.298-300. PMID [www.ncbi.nlm.nih.gov/pubmed/13332224 13332224]
- ↑ Nie B, Gan W, Shi F, Hu GX, Chen LG, Hayakawa H, Sekiguchi M, Cai JP Nie B, Gan W, Shi F, Hu GX, Chen LG, Hayakawa H, Sekiguchi M, Cai JP "Age-dependent accumulation of 8-oxoguanine in the DNA and RNA in various rat tissues // Oxidative Medicine and Cellular Longevity.— 2013.— Vol.2013 DOI:10.1155/2013/303181 PMID [www.ncbi.nlm.nih.gov/pubmed/23738036 23738036]
- ↑ Hamilton ML, Van Remmen H, Drake JA, Yang H, Guo ZM, Kewitt K, Walter CA, Richardson A "Does oxidative damage to DNA increase with age? // Proc. Natl. Acad. Sci. U.S.A.— 2001.— Vol.98(18).— P.10469-74. PMID [www.ncbi.nlm.nih.gov/pubmed/11517304 11517304]
- ↑ Toyokuni S. Molecular mechanisms of oxidative stress-induced carcinogenesis: from epidemiology to oxygenomics // IUBMB Life.— 2008.— Vol.60(7).— P.441-7 DOI:10.1002/iub.61 PMID [www.ncbi.nlm.nih.gov/pubmed/18465793 18465793]
- ↑ Nishida N, Arizumi T, Takita M, Kitai S, Yada N, Hagiwara S, Inoue T, Minami Y, Ueshima K, Sakurai T, Kudo M Reactive oxygen species induce epigenetic instability through the formation of 8-hydroxydeoxyguanosine in human hepatocarcinogenesis // Dig Dis.— 2013.— Vol.31.— 459-66. DOI:10.1159/000355245 PMID [www.ncbi.nlm.nih.gov/pubmed/24281021 24281021]
