Аминоацил-тРНК-синтетаза
| Антикодон связывающий домен | |||||||||
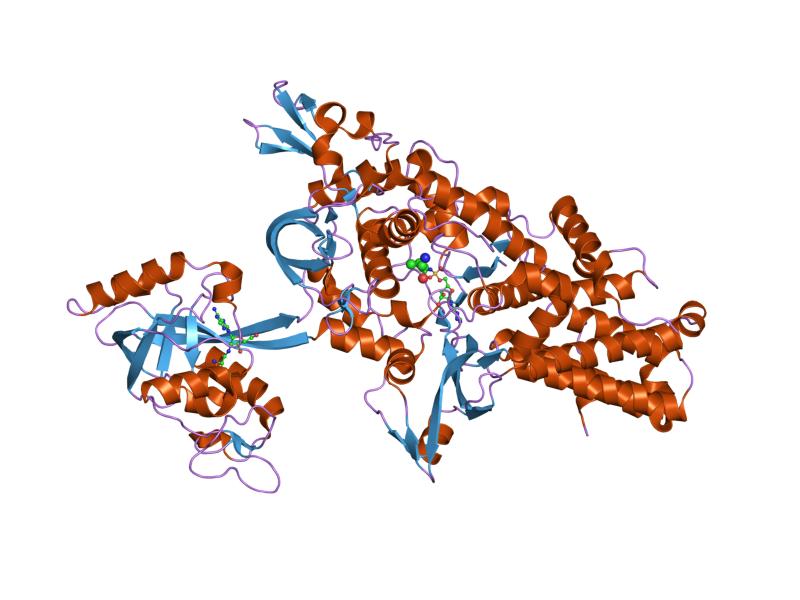 лейцил-тРНК синтетаза из Thermus thermophilus | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ |
Anticodon_1 | ||||||||
| Pfam |
[pfam.xfam.org/family?acc=PF08264 PF08264] | ||||||||
| InterPro |
[www.ebi.ac.uk/interpro/entry/IPR013155 IPR013155] | ||||||||
| SCOP |
[scop.mrc-lmb.cam.ac.uk/scop/search.cgi?tlev=fa;&pdb=1ivs 1ivs] | ||||||||
| SUPERFAMILY |
[supfam.org/SUPERFAMILY/cgi-bin/search.cgi?search_field=1ivs 1ivs] | ||||||||
| |||||||||
| DALR антикодон связывающий домен 1 | |||||||||
 аргинил-тРНК синтетаза из Thermus thermophilus | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ |
DALR_1 | ||||||||
| Pfam |
[pfam.xfam.org/family?acc=PF05746 PF05746] | ||||||||
| Pfam clan |
[pfam.xfam.org/clan/CL0258 CL0258] | ||||||||
| InterPro |
[www.ebi.ac.uk/interpro/entry/IPR008909 IPR008909] | ||||||||
| SCOP |
[scop.mrc-lmb.cam.ac.uk/scop/search.cgi?tlev=fa;&pdb=1bs2 1bs2] | ||||||||
| SUPERFAMILY |
[supfam.org/SUPERFAMILY/cgi-bin/search.cgi?search_field=1bs2 1bs2] | ||||||||
| |||||||||
| DALR антикодон связывающий домен 2 | |||||||||
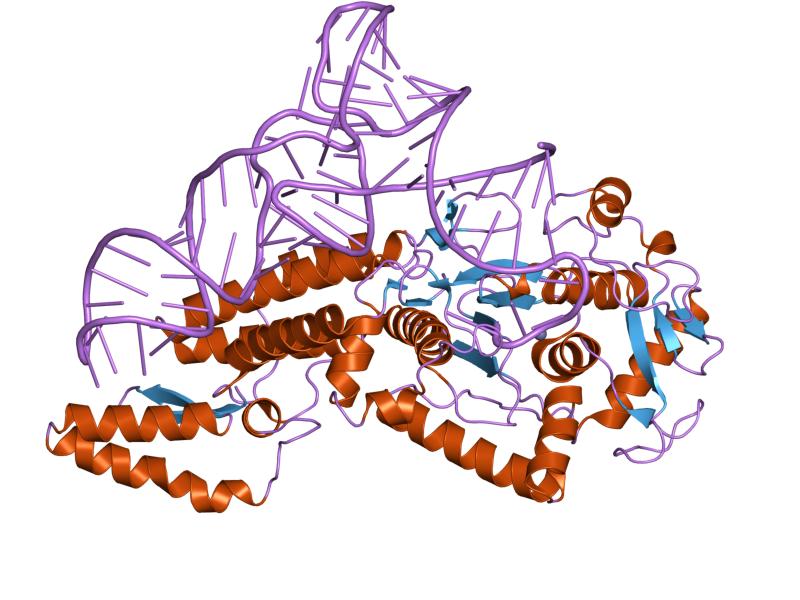 Структуры цистенил-тРНК синтетазы в комплексе с тРНКCys | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ |
DALR_2 | ||||||||
| Pfam |
[pfam.xfam.org/family?acc=PF09190 PF09190] | ||||||||
| Pfam clan |
[pfam.xfam.org/clan/CL0258 CL0258] | ||||||||
| InterPro |
[www.ebi.ac.uk/interpro/entry/IPR015273 IPR015273] | ||||||||
| |||||||||
АРСазы обеспечивают соответствие нуклеотидным триплетам генетического кода (антикодону тРНК) встраиваемых в белок аминокислот, и, таким образом, обеспечивают правильность происходящего в дальнейшем считывания генетической информации с мРНК при синтезе белков на рибосомах.
Содержание
Аминоацилирование
-
аминокислота + АТФ → аминоацил-АМФ + PPi— АТФ активирует аминокислоту -
аминоацил-AМФ + тРНК → аминоацил-тРНК + АМФ— активированная аминокислота соединяется с соответствующей тРНК
Суммарное уравнение двух реакций:
аминокислота + тРНК + АТФ → аминоацил-тРНК + АМФ + PPi
Механизм аминоацилирования
Сначала в активном центре синтетазы связываются соответствующая аминокислота и АТФ. Из трёх фосфатных групп АТФ две отщепляются, образуя молекулу пирофосфата (PPi), а на их место становится аминокислота. Образованное соединение (аминоацил-аденилат) состоит из ковалентно связанных высокоэнергетической связью аминокислотного остатка и АМФ. Энергии, содержащейся в этой связи, хватает на все дальнейшие этапы, необходимые для того, чтобы аминокислотный остаток занял своё место в полипептидной цепи (то есть в белке). Аминоацил-аденилаты нестабильны и легко гидролизуются, если диссоциируют из активного центра синтетазы. Когда аминоацил-аденилат сформирован, с активным центром синтетазы связывается 3'-конец тРНК, антикодон которой соответствует активируемой этой синтетазой аминокислоте. Происходит перенос аминокислотного остатка с аминоацил-аденилата на 2'- либо 3'-ОН группу рибозы, входящей в состав последнего на 3'-конце аденина тРНК. Таким образом синтезируется аминоацил-тРНК, то есть тРНК несущая ковалентно присоединённый аминокислотный остаток. От аминоацил-аденилата при этом остаётся только АМФ. И аминоацил-тРНК, и АМФ освобождаются активным центром.
Безошибочность узнавания аминокислот
Каждая из 20-ти аминоацил-тРНК синтетаз должна всегда прикреплять к тРНК только свою аминокислоту, узнавая только одну из 20-ти протеиногенных аминокислот, и не связывая другие похожие молекулы, содержащиеся в цитоплазме клетки. Аминокислоты значительно меньше тРНК по размерам, неизмеримо проще по структуре, поэтому их узнавание является значительно большей проблемой, чем узнавание нужной тРНК. В действительности, ошибки имеют место, но их уровень не превышает одной на 10,000 — 100,000 синтезированных аминоацил-тРНК[1].
Некоторые аминокислоты отличаются друг от друга очень слабо, например, лишь одной метильной группой (изолейцин и валин, аланин и глицин). Для таких случаев во многих аминоацил-тРНК синтетазах эволюционировали механизмы, избирательно расщепляющие ошибочно синтезированные продукты. Процесс их распознавания и гидролиза называют редактированием. Избирательное расщепление аминоацил-аденилата называют претрансферным редактированием, так как оно происходит до переноса аминокислотного остатка на тРНК, а расщепление готовой аминоацил-тРНК — посттрансферным редактированием. Претрансферное редактирование, как правило, происходит в том же активном центре, что и аминоацилирование. Посттрансферное редактирование требует попадания 3'-конца аминоацил-тРНК с прикреплённым к нему остатком аминокислоты во второй активный центр аминоацил-тРНК синтетазы — редактирующий. Этот второй активный центр есть не у всех аминоацил-тРНК синтетаз, а у тех, у которых есть, находится в отдельном домене глобулы фермента. Встречаются также свободно плавающие ферменты, участвующие в посттрансферном редактировании. После гидролиза разъединённые аминокислота и тРНК (или аминокислота и АМФ) высвобождаются в раствор[2].
Классификация
Все аминоацил-тРНК-синтетазы произошли от двух предковых форм и объединены на основе структурного сходства в два класса. Эти классы отличаются по доменной организации, структуре главного (аминоацилирующего) домена, способу связывания и аминоацилирования тРНК [3] . Аминоацилирующий домен аминоацил-тРНК-синтетаз 1-го класса образован так называемой укладкой Россмана, в основе которой лежит параллельный β-лист. Ферменты 1-го класса являются в большинстве случаев мономерами. 76-й аденозин тРНК они аминоацилируют по 2'-ОН группе. Ферменты 2-го класса имеют в основе структуры аминоацилирующего домена антипараллельный β-лист. Как правило они являются димерами, то есть имеют четвертичную структуру. За исключением фенилаланил-тРНК синтетазы все они аминоацилируют 76-й аденозин тРНК по 3'-ОН группе. Каждый класс дополнительно делится на 3 подкласса — a, b и c по структурному сходству. Зачастую аминоацил-тРНК-синтетазы одной и той же специфичности (напр., пролил-тРНК синтетаза) существенно отличаются друг у друга у бактерий, архебактерий и эукариот. Тем не менее, ферменты одной специфичности почти всегда более сходны между собой, чем с ферментами других специфичностей. Исключение составляют две различные лизил-тРНК синтетазы, одна из которых относится к 1-му классу, а другая — ко 2-му.
Доменная организация
Каждая молекула аминоацил-тРНК синтетазы состоит из двух основных доменов — аминоацилирующего, в котором располагается активный центр и происходят реакции, и антикодон-связывающего, узнающего последовательность антикодона тРНК. Также часто встречаются редактирующие домены, служащие для гидролиза аминоацил-тРНК, несущих не тот аминокислотный остаток, и другие домены[4].
Эволюция
В добелковой жизни (РНК-мире) функцию аминоацил-тРНК синтетаз выполняли, по всей видимости, рибозимы, то есть молекулы РНК, обладающие каталитическими свойствами. В настоящее время такие молекулы воссозданы в лаборатории методом «эволюции в пробирке»[5]. После становления основных элементов аппарата белкового синтеза функция аминоацилирования тРНК перешла к белковым молекулам, восходящим к двум предковым последовательностям. Первоначально эти ферменты состояли только из одного, аминоацилирующего, домена. По мере становления генетического кода росло разнообразие аминоацил-тРНК синтетаз и повышались требования к их специфичности. Это и привело к включению в их структуру дополнительных доменов. Первичная последовательность аминоацил-тРНК синтетаз за время их эволюции дивергировала очень существенно, что впрочем не помешало обнаружить в пределах каждого из классов гомологию как первичной последовательности, так и третичной (пространственной) структуры[4].
Технологические перспективы
Мутантные аминоацил-тРНК синтетазы и тРНК используются для включения в белки аминокислот, не предусмотренных генетическим кодом[6].
Примечания
- ↑ [www.ncbi.nlm.nih.gov/pmc/articles/PMC1174024/?tool=pubmed The frequency of errors in protein biosynthesis]. Проверено 11 августа 2010.
- ↑ [www.ncbi.nlm.nih.gov/pmc/articles/PMC327334/?tool=pubmed Alternative pathways for editing non-cognate amino acids by aminoacyl-tRNA synthetases.]. Проверено 11 августа 2010.
- ↑ [www.nature.com/nature/journal/v347/№ 6289/pdf/347203a0.pdf Partition of tRNA synthetases into two classes based on mutually exclusive sets of sequence motifs.](недоступная ссылка — 6289/pdf/347203a0.pdf история). Проверено 11 августа 2010.
- ↑ 1 2 [mmbr.asm.org/cgi/content/full/67/4/550?view=long&pmid=14665676 On the evolution of structure in aminoacyl-tRNA synthetases.]. Проверено 3 ноября 2011. [www.webcitation.org/66hGub4XU Архивировано из первоисточника 5 апреля 2012].
- ↑ [molbio.mgh.harvard.edu/szostakweb/publications/Szostak_pdfs/Lee_Szostak_Suga_NSB_00.pdf Ribozyme-catalyzed tRNA aminoacylation.]. Проверено 11 августа 2010. [www.webcitation.org/66hGvPkUW Архивировано из первоисточника 5 апреля 2012].
- ↑ [nar.oxfordjournals.org/cgi/content/full/30/21/4692?view=long&pmid=12409460 Site-specific incorporation of an unnatural amino acid into proteins in mammalian cells.]. Проверено 11 августа 2010. [www.webcitation.org/66hGvtkd3 Архивировано из первоисточника 5 апреля 2012].
| В другом языковом разделе есть более полная статья Aminoacyl tRNA synthetase (англ.) Вы можете помочь проекту, расширив текущую статью с помощью перевода.
|
<imagemap>: неверное или отсутствующее изображение |
Для улучшения этой статьи желательно?:
|
