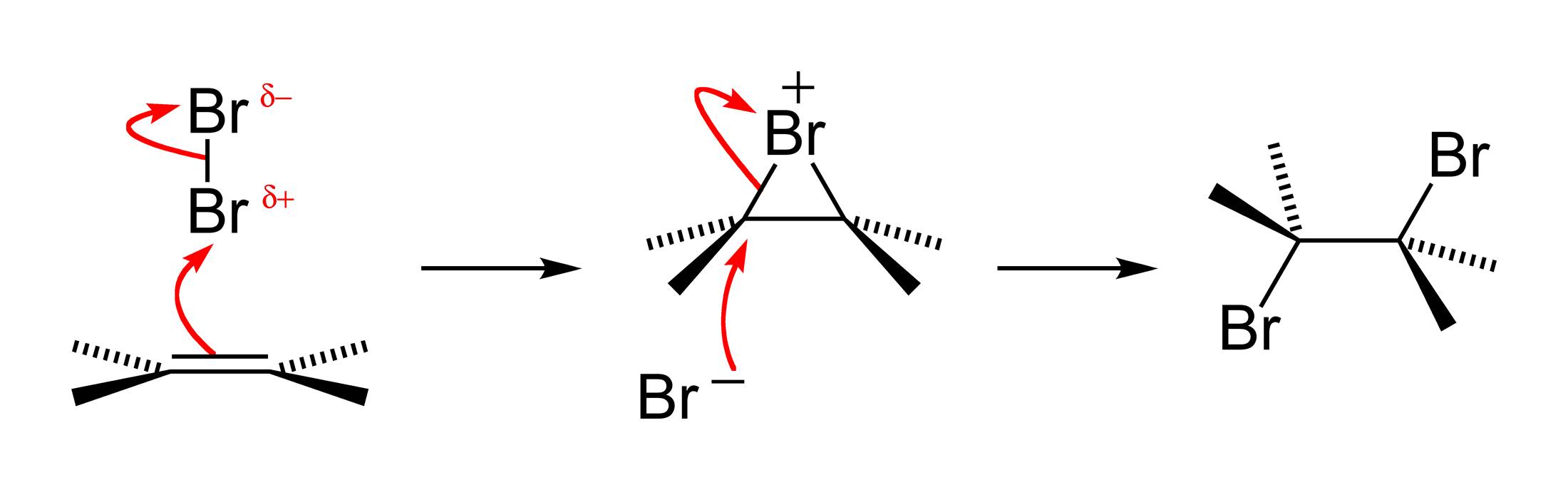Реакции электрофильного присоединения
Реакции электрофильного присоединения (англ. addition electrophilic reaction) — реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся карбкатион подвергается нуклеофильной атаке.
В органической химии чаще всего атакующей электрофильной частицей является протон H+.
Несмотря на общность механизма различают реакции присоединения по связи углерод—углерод и углерод—гетероатом.
Общий вид реакций присоединения по двойной связи углерод-углерод:
<math>\mathsf{-\stackrel{|}{C}\!\!=\!\!\stackrel{|}{C}\!\!-+\ X^+}\rightarrow\mathsf{-\stackrel{|\ }{C^+}\!\!-\!\!\stackrel{|\ }{CX}\!-}</math>
<math>\mathsf{-\stackrel{|\ }{C^+}\!\!-\!\!\stackrel{|\ }{CX}\!-\!+\ Y^-}\rightarrow\mathsf{-\stackrel{|\ }{CY}\!\!-\!\!\stackrel{|\ }{CX}\!-}</math>
Реакции электрофильного присоединения распространены среди алкенов и алкинов и широко используются в промышленном химическом производстве и лабораторных синтезах.
Содержание
Реакции электрофильного присоединения по связи углерод-углерод
Механизм реакций электрофильного присоединения по связи углерод-углерод
Электрофильное присоединение по кратной связи обычно, двухстадийный процесс AdE2 — реакция бимолекулярного электрофильного присоединения (англ. addition electrophilic bimolecular). На первом этапе происходит атака электрофила и образование π-комплекса, который затем расщепляется, а далее образовавшийся карбкатион подвергается нуклеофильной атаке[1]:
Обычно, скорость лимитирующей является первая стадия реакции, хотя встречаются редкие исключения[2].
Аналогично происходит присоединение к алкинам:
Реже встречается механизм AdE3 — реакция тримолекулярного электрофильного присоединения с одновременной атакой трех частиц[2]:
Реакции электрофильного присоединения более характерны для непредельных соединений, чем нуклеофильного, что объясняется пространственной доступностью π-электронов двойной связи электронодефицитных атакующих частиц X+[1].
Как и в реакциях ароматического электрофильного замещения, электронодонорные заместители повышают реакционную способность субстрата, а электроноакцепторные её снижают[2].
Присоединение галогенов
Присоединение галогенов по механизму AdE2 является едва ли не самой распространенной реакцией подобного рода. На первом этапе образуется π-комплекс, который в дальнейшем преобразуется в σ-комплекс и далее в дигалогенпроизводное[3]:
Присоединение брома — анти-присоединение, то есть присоединение с противоположной стороны, относительно плоскости молекулы алкена[3]. Это весьма наглядно представляется с помощью формул Ньюмена.
Подтверждение данного механизма обнаруживается при исследовании бромирования малеиновой и фумаровой кислот.
В первом случае образуется смесь энантиомеров, во втором — только один продукт:
Кинетика реакции бромирования обычно довольно сложна[3]:
| Скорость реакции = k1*[RRC=CRR]*[Br2]+k2*[RRC=CRR]*[Br2]²+k3*[RRC=CRR]*[Br2]*[Br-] |
Хлорирование чаще дает более простую зависимость [4]:
| Скорость реакции = k1*[RRC=CRR]*[Cl2] |
Присоединение галогеноводородов
В отсутствии свободных радикалов* присоединение галогеноводородов подчиняется правилу Марковникова:
* Возможность проведения присоединения по свободнорадикальному механизму реализуется только для HBr и в редких случаях для HCl[2]
Стереохимически присоединение галогеноводородов к алкенам, обычно — анти-присоединение[4]. К син-присоединению склонны стирол, инден, аценафтилен и их производные[3].
Алкины способны присоединить две молекулы галогеноводорода:
Другие типичные реакции электрофильного присоединения
1. Гидратация.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\! CH_2+H_2O}\rightarrow\mathsf{R\!\!-\!\!CH(OH)\!\!-\!\!CH_3}</math>
2. Присоединение спирта с образованием простого эфира.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!OH}\rightarrow\mathsf{R\!\!-CH(OR')\!\!-CH_3}</math>
<math>\mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'\!\!-\!\!OH}\rightarrow\mathsf{R\!\!-C(OR')\!\!=CH_2}</math>
3. Присоединение хлорноватистой кислоты с образованием хлоргидринов.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+Cl_2+ H_2O}\rightarrow\mathsf{R\!\!-\!\!CH(OH)\!\!-\!\!CH_2Cl +HCl}</math>
4. Присоединение хлорангидридов и/или карбоновых кислот.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!COCl}\rightarrow\mathsf{R\!\!-\!\!CHCl\!\!-\!\! CH_2COR'}</math>
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!COOH}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2OCOR'}</math>
<math>\mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'\!\!-\!\!COOH}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CHOCOR'}</math>
5. Присоединение аммиака и/или аминов.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+NH_3}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2NH_2}</math>
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'NH_2}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2NHR'}</math>
<math>\mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'NH_2}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CH\!\!-\!\!NHR'}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\!CH\!\!=\!\!NR'}</math>
6. Карбонилирование.
<math>\mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+CO+HY}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2COY}</math>
<math>\mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+CO+HY}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CHCOY}</math>
<math>\mathsf{HY: H_2O, ROH, RCOOH, NH_3, RNH_2, HCN}</math>.
Реакции электрофильного присоединения по связи углерод-гетероатом
Механизм реакций электрофильного присоединения по связи углерод-гетероатом
Электрофильное присоединение по кратной связи углерод-гетероатом имеет механизм AdE2:
Иногда продукты присоединения вступают в реакцию отщепления, тем самым совокупно давая реакцию замещения:
Связи углерод-гетероатом очень полярны, при этом на углероде формируется положительный заряд, а на гетероатоме — отрицательный. Соответственно, первоначальная атака может идти как по атому углерода (электрофильная атака), так и по гетероатому (нуклеофильная атака). В подавляющем большинстве случаев реакции присоединения по по кратной связи углерод-гетероатом носят нуклеофильный характер[2].
Типичные реакции электрофильного присоединения по связи C=O
1. Присоединение нитрилов к альдегидам.
<math>\mathsf{R\!\!-\!\!CHO+2R'CN}\rightarrow\mathsf{R\!\!-\!\!CH(NHCOR')_2}</math>
2. Реакция Принса.
Типичные реакции электрофильного присоединения по связи C=N и С≡N
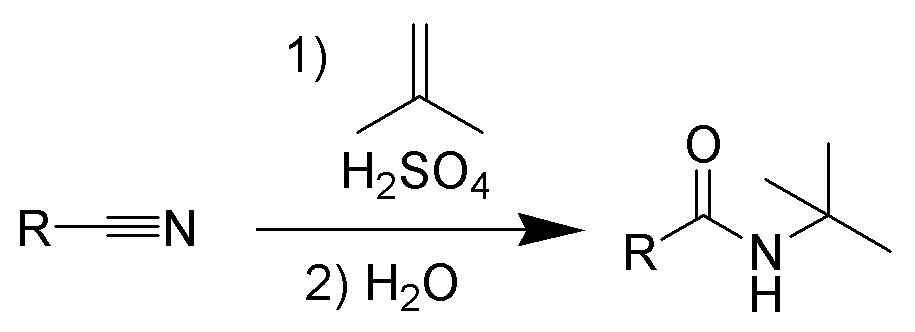
1. Реакция Риттера.
2. Тримеризация нитрилов.
3. Гидролиз нитрилов и изонитрилов.
<math>\mathsf{R\!\!-\!\!CN+H_2O}\rightarrow\mathsf{R\!\!-\!\!CO\!\!-\!\!NH_2}</math>
<math>\mathsf{R\!\!-\!\!NC+H_2O}\rightarrow\mathsf{R\!\!-\!\!NH\!\!-\!\!CHO}</math>
4. Алкоголиз нитрилов.
<math>\mathsf{R\!\!-\!\!CN+R'OH+H_2O+H^+}\rightarrow\mathsf{R\!\!-\!\!CO\!\!-\!\!OR'+NH_4^+}</math>
Напишите отзыв о статье "Реакции электрофильного присоединения"
Примечания
- ↑ 1 2 Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- ↑ 1 2 3 4 5 Mарч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑ 1 2 3 4 Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ 1 2 Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
| ||||||||||||||||||||||||||
Отрывок, характеризующий Реакции электрофильного присоединения
– Соня, ты прочла письмо? – сказала она.– Да, – тихо сказала Соня.
Наташа восторженно улыбнулась.
– Нет, Соня, я не могу больше! – сказала она. – Я не могу больше скрывать от тебя. Ты знаешь, мы любим друг друга!… Соня, голубчик, он пишет… Соня…
Соня, как бы не веря своим ушам, смотрела во все глаза на Наташу.
– А Болконский? – сказала она.
– Ах, Соня, ах коли бы ты могла знать, как я счастлива! – сказала Наташа. – Ты не знаешь, что такое любовь…
– Но, Наташа, неужели то всё кончено?
Наташа большими, открытыми глазами смотрела на Соню, как будто не понимая ее вопроса.
– Что ж, ты отказываешь князю Андрею? – сказала Соня.
– Ах, ты ничего не понимаешь, ты не говори глупости, ты слушай, – с мгновенной досадой сказала Наташа.
– Нет, я не могу этому верить, – повторила Соня. – Я не понимаю. Как же ты год целый любила одного человека и вдруг… Ведь ты только три раза видела его. Наташа, я тебе не верю, ты шалишь. В три дня забыть всё и так…
– Три дня, – сказала Наташа. – Мне кажется, я сто лет люблю его. Мне кажется, что я никого никогда не любила прежде его. Ты этого не можешь понять. Соня, постой, садись тут. – Наташа обняла и поцеловала ее.
– Мне говорили, что это бывает и ты верно слышала, но я теперь только испытала эту любовь. Это не то, что прежде. Как только я увидала его, я почувствовала, что он мой властелин, и я раба его, и что я не могу не любить его. Да, раба! Что он мне велит, то я и сделаю. Ты не понимаешь этого. Что ж мне делать? Что ж мне делать, Соня? – говорила Наташа с счастливым и испуганным лицом.
– Но ты подумай, что ты делаешь, – говорила Соня, – я не могу этого так оставить. Эти тайные письма… Как ты могла его допустить до этого? – говорила она с ужасом и с отвращением, которое она с трудом скрывала.
– Я тебе говорила, – отвечала Наташа, – что у меня нет воли, как ты не понимаешь этого: я его люблю!
– Так я не допущу до этого, я расскажу, – с прорвавшимися слезами вскрикнула Соня.
– Что ты, ради Бога… Ежели ты расскажешь, ты мой враг, – заговорила Наташа. – Ты хочешь моего несчастия, ты хочешь, чтоб нас разлучили…
Увидав этот страх Наташи, Соня заплакала слезами стыда и жалости за свою подругу.
– Но что было между вами? – спросила она. – Что он говорил тебе? Зачем он не ездит в дом?
Наташа не отвечала на ее вопрос.
– Ради Бога, Соня, никому не говори, не мучай меня, – упрашивала Наташа. – Ты помни, что нельзя вмешиваться в такие дела. Я тебе открыла…
– Но зачем эти тайны! Отчего же он не ездит в дом? – спрашивала Соня. – Отчего он прямо не ищет твоей руки? Ведь князь Андрей дал тебе полную свободу, ежели уж так; но я не верю этому. Наташа, ты подумала, какие могут быть тайные причины ?
Наташа удивленными глазами смотрела на Соню. Видно, ей самой в первый раз представлялся этот вопрос и она не знала, что отвечать на него.
– Какие причины, не знаю. Но стало быть есть причины!
Соня вздохнула и недоверчиво покачала головой.
– Ежели бы были причины… – начала она. Но Наташа угадывая ее сомнение, испуганно перебила ее.
– Соня, нельзя сомневаться в нем, нельзя, нельзя, ты понимаешь ли? – прокричала она.
– Любит ли он тебя?
– Любит ли? – повторила Наташа с улыбкой сожаления о непонятливости своей подруги. – Ведь ты прочла письмо, ты видела его?
– Но если он неблагородный человек?
– Он!… неблагородный человек? Коли бы ты знала! – говорила Наташа.
– Если он благородный человек, то он или должен объявить свое намерение, или перестать видеться с тобой; и ежели ты не хочешь этого сделать, то я сделаю это, я напишу ему, я скажу папа, – решительно сказала Соня.
– Да я жить не могу без него! – закричала Наташа.
– Наташа, я не понимаю тебя. И что ты говоришь! Вспомни об отце, о Nicolas.
– Мне никого не нужно, я никого не люблю, кроме его. Как ты смеешь говорить, что он неблагороден? Ты разве не знаешь, что я его люблю? – кричала Наташа. – Соня, уйди, я не хочу с тобой ссориться, уйди, ради Бога уйди: ты видишь, как я мучаюсь, – злобно кричала Наташа сдержанно раздраженным и отчаянным голосом. Соня разрыдалась и выбежала из комнаты.
Наташа подошла к столу и, не думав ни минуты, написала тот ответ княжне Марье, который она не могла написать целое утро. В письме этом она коротко писала княжне Марье, что все недоразуменья их кончены, что, пользуясь великодушием князя Андрея, который уезжая дал ей свободу, она просит ее забыть всё и простить ее ежели она перед нею виновата, но что она не может быть его женой. Всё это ей казалось так легко, просто и ясно в эту минуту.
В пятницу Ростовы должны были ехать в деревню, а граф в среду поехал с покупщиком в свою подмосковную.
В день отъезда графа, Соня с Наташей были званы на большой обед к Карагиным, и Марья Дмитриевна повезла их. На обеде этом Наташа опять встретилась с Анатолем, и Соня заметила, что Наташа говорила с ним что то, желая не быть услышанной, и всё время обеда была еще более взволнована, чем прежде. Когда они вернулись домой, Наташа начала первая с Соней то объяснение, которого ждала ее подруга.
– Вот ты, Соня, говорила разные глупости про него, – начала Наташа кротким голосом, тем голосом, которым говорят дети, когда хотят, чтобы их похвалили. – Мы объяснились с ним нынче.
– Ну, что же, что? Ну что ж он сказал? Наташа, как я рада, что ты не сердишься на меня. Говори мне всё, всю правду. Что же он сказал?
Наташа задумалась.
– Ах Соня, если бы ты знала его так, как я! Он сказал… Он спрашивал меня о том, как я обещала Болконскому. Он обрадовался, что от меня зависит отказать ему.
Соня грустно вздохнула.
– Но ведь ты не отказала Болконскому, – сказала она.
– А может быть я и отказала! Может быть с Болконским всё кончено. Почему ты думаешь про меня так дурно?
– Я ничего не думаю, я только не понимаю этого…
– Подожди, Соня, ты всё поймешь. Увидишь, какой он человек. Ты не думай дурное ни про меня, ни про него.
– Я ни про кого не думаю дурное: я всех люблю и всех жалею. Но что же мне делать?
Соня не сдавалась на нежный тон, с которым к ней обращалась Наташа. Чем размягченнее и искательнее было выражение лица Наташи, тем серьезнее и строже было лицо Сони.
– Наташа, – сказала она, – ты просила меня не говорить с тобой, я и не говорила, теперь ты сама начала. Наташа, я не верю ему. Зачем эта тайна?
– Опять, опять! – перебила Наташа.
– Наташа, я боюсь за тебя.
– Чего бояться?
– Я боюсь, что ты погубишь себя, – решительно сказала Соня, сама испугавшись того что она сказала.
Лицо Наташи опять выразило злобу.
– И погублю, погублю, как можно скорее погублю себя. Не ваше дело. Не вам, а мне дурно будет. Оставь, оставь меня. Я ненавижу тебя.
– Наташа! – испуганно взывала Соня.
– Ненавижу, ненавижу! И ты мой враг навсегда!
Наташа выбежала из комнаты.
Наташа не говорила больше с Соней и избегала ее. С тем же выражением взволнованного удивления и преступности она ходила по комнатам, принимаясь то за то, то за другое занятие и тотчас же бросая их.
Как это ни тяжело было для Сони, но она, не спуская глаз, следила за своей подругой.