Окислительное фосфорилирование
Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клеток в виде АТФ. Хотя различные формы жизни на Земле используют разные питательные вещества, АТФ является универсальным соединением, в котором запасается энергия, необходимая для других метаболических процессов. Почти все аэробные организмы осуществляют окислительное фосфорилирование. Вероятно, широкому распространению этого метаболического пути способствовала его высокая энергетическая эффективность по сравнению с анаэробным брожением.
При окислительном фосфорилировании происходит перенос электронов от соединений-доноров к соединениям-акцепторам в ходе окислительно-восстановительных реакций. В ходе этих реакций выделяется энергия, которая далее запасается в виде АТФ. У эукариот эти окислительно-восстановительные реакции осуществляются несколькими белковыми комплексами, локализованными во внутренней митохондриальной мембране, а у прокариот они располагаются в межмембранном пространстве[en] клетки. Этот набор связанных белков составляет электроно-транспортную цепь (ЭТЦ). У эукариот в состав ЭТЦ входит пять белковых комплексов, в то время как у прокариот её составляют множество различных белков, работающих с различными донорами и акцепторами электронов.
Энергия, выделяющаяся при движении электронов по ЭТЦ, используется для транспорта протонов через внутреннюю митохондриальную мембрану в межмембранное пространство[en]. Таким образом накапливается потенциальная энергия, слагающаяся из протонного градиента и электрического потенциала. Эта энергия высвобождается при возвращении протонов обратно в митохондриальный матрикс по их электрохимическому градиенту. Это возвращение происходит через особый белковый комплекс — АТФ-синтазу; сам процесс перемещения протонов по их электрохимическому градиенту получил название хемиосмос. АТФ-синтаза использует выделяющуюся при хемиосмосе энергию для синтеза АТФ из АДФ в ходе реакции фосфорилирования. Эта реакция запускается потоком протонов, которые вызывают вращение части АТФ-синтазы; таким образом, АТФ-синтаза работает как вращающийся молекулярный мотор.
Хотя окислительное фосфорилирование относится к жизненно важным реакциям фосфорилирования, в ходе этого процесса также образуются активные формы кислорода, в частности, супероксид и пероксид водорода. Они вызывают образование в клетках свободных радикалов, которые причиняют вред клеткам, приводя к болезням и старению. Ферменты окислительного фосфорилирования являются мишенями для многих биологически активных веществ и ядов, которые подавляют их активность.
Окислительное фосфорилирование следует отличать от субстратного фосфорилирования, при котором АТФ синтезируется не за счёт энергии переноса электронов и протонов по цепи переносчиков, а при фосфорилировании АДФ до АТФ при отрыве фосфата от соединений с высоким потенциалом переноса фосфата[1].
Содержание
Общий обзор
Механизм окислительного фосфорилирования основан на использовании реакций, в ходе которых энергия высвобождается (экзергонических), для проведения реакций, которые протекают с затратой энергии (эндергонических). Переход электронов по электроно-транспортной цепи от доноров электронов (например, НАДН) к акцепторам (например, кислороду) является экзергоническим процессом: в ходе него выделяется энергия, в то время как синтез АТФ — эндергонический процесс, для него необходим приток энергии извне. И ЭТЦ, и АТФ-синтаза располагаются в мембране, и энергия переносится от ЭТЦ к АТФ-синтазе посредством переноса протонов через мембрану в ходе хемиосмоса[2]. По сути, этот механизм напоминает электрическую цепь, в которой протоны переносятся с отрицательно заряженной стороны мембраны (N-сторона) на положительно заряженную сторону под действием ферментов ЭТЦ, функционирующих как протонные помпы. Работу этих ферментов можно сравнить с работой батареи, вызывающей движение электрического тока по цепи. Передвижение протонов через мембрану создаёт электрохимический градиент, который часто также называют протонодвижущей силой. Этот градиент слагается из двух составляющих: разницы в концентрации протонов (Н+-градиент, ΔpH) и разности электрических потенциалов, причём N-сторона заряжена отрицательно[3].
АТФ-синтаза высвобождает эту энергию протонов, замыкая электрическую цепь и позволяя протонам перемещаться по их электрохимическому градиенту обратно на N-сторону мембраны[4]. Их кинетическая энергия запускает вращение некоторых частей фермента, и за счёт этого вращения осуществляется синтез АТФ.
Работа ЭТЦ и АТФ-синтазы тесно связаны друг с другом. При блокировании передвижения электронов по ЭТЦ образование АТФ приостанавливается. Верно и обратное: подавление АТФ-синтазы блокирует работу ЭТЦ и переход электронов по её белкам. Это объясняется следующим образом. АТФ-синтаза, синтезируя АТФ, возвращает в матрикс протоны, накачанные в межмембранное пространство белками ЭТЦ за счёт особого канала в ферменте. Если же его заблокировать, то белки ЭТЦ будут накачивать протоны в межмебранное пространство до тех пор, пока протонный градиент по обе стороны мембраны не сравняется. Так как остановится накачивание протонов, остановится и движение электронов, и система придёт в равновесие[5].
Две составляющих электрохимического потенциала, электрический мембранный потенциал и химический потенциал, термодинамически не эксвивалентны: в митохондриях большая часть синтезируемого АТФ образуется за счёт разности потенциалов, а у алкалифильных бактерий часть электрической энергии даже идёт на компенсацию внешнего рН (отрицательный заряд бактерии помогает отталкивать гидроксильные ионы). В хлоропластах, напротив, больший вклад в синтез АТФ вносит ΔpH, хотя и там тоже есть небольшой мембранный потенциал, который необходим для синтеза АТФ. У фузобактерии Propionigenium modestum[en] он вызывает противонаправленное вращение субъединиц а и с в мембранном FO-домене АТФ-синтазы[3]. Из этих данных следует, что электрический потенциал также важен для синтеза АТФ как и химический потенциал.
По сравнению с брожением, окислительное фосфорилирование даёт большой энергетический выход. У гликолиза суммарный выход АТФ составляет всего 2 молекулы, однако в ходе окислительного фосфорилирования синтезируется от 30 до 36 молекул АТФ за счёт 10 НАДН и 2 молекул сукцината, образовавшихся при окислении одной молекулы глюкозы до углекислого газа и воды[6], в то время как β-окисление жирных кислот даёт около 14 молекул АТФ. Выше представлены теоретические, максимально возможные значения выхода АТФ. В действительности же некоторые протоны просачиваются сквозь мембрану, минуя АТФ-синтазу, что снижает выход АТФ[7].
В отличие от нормальных дифференцированных клеток, у которых основным источником энергии служит окислительное фосфорилирование, раковые клетки преимущественно полагаются на аэробный гликолиз. Этот феномен получил название эффекта Варбурга. По-видимому, для раковых и других быстро пролиферирующих клеток, нуждающихся в быстром увеличении биомассы, более быстрый гликолиз оказывается выгоднее трудоёмкого окислительного фосфорилирования[8]. Такая отличительная особенность раковых клеток (увеличенные темпы гликолиза, по сравнению с нормальными клетками) позволяет определять местоположение раковой опухоли в теле при помощи позитронно-эмиссионной томографии[9].
Молекулы-переносчики электронов и протонов
В электроно-транспортной цепи происходит движение как электронов, перемещающихся от донора к акцептору, так и протонов, движущихся через мембрану. В этих процессах участвуют и растворимые, и связанные с белками транспортные молекулы. В митохондриях перенос электронов в межмембранном пространстве осуществляется водорастворимым белком-переносчиком цитохромом с[10]. Этот белок переносит исключительно электроны, а перенос осуществляется за счёт окисления и восстановления атома железа, который располагается в гемовой группе белка. Цитохром с также обнаружен у некоторых бактерий, у которых он располагается в периплазматическом пространстве[11].
Во внутренней митохондриальной мембране функционирует жирорастворимый переносчик кофермент Q, который переносит за счёт окислительно-восстановительных циклических реакций и электроны, и протоны[12]. Эта небольшая бензохиноновая[en] молекула чрезвычайно гидрофобна и свободно перемещается в мембране. Когда Q получает два электрона и два протона, он восстанавливается до убихинола (QH2); когда QH2 высвобождает два электрона и два протона, он вновь окисляется до убихинона(Q). Поэтому если два фермента располагаются так, что Q восстанавливается на одной стороне мембраны и QH2 окисляется на другой, то убихинон свяжет эти реакции и обеспечит челночный транспорт протонов между ними[13]. В некоторых ЭТЦ бактерий задействованы другие хиноны, например, менахинон, помимо убихинона[14].
Перенос электронов между белками обусловлен их переносом между флавиновыми кофакторами[4][15], железо-серными кластерами и цитохромами. Существует несколько типов железо-серных кластеров. В простейшем случае железо-серный кластер состоит из двух атомов железа, соединенных посредством двух атомов неорганической серы; кластеры такого рода обозначаются как [2Fe-2S]. Кластеры второго рода, обозначаемые как [4Fe-4S], содержат организованные в куб четыре атома железа и четыре атома серы; каждый атом железа в таких кластерах координируется дополнительной аминокислотой, обычно цистеином за счёт его атома серы. Ион металла участвует в окислительно-восстановительных реакциях без присоединения или отдачи протонов, поэтому в ЭТЦ они могут быть задействованы только в транспорте электронов от белка к белку. Электроны проходят довольно большое расстояние через белки, «перепрыгивая» с одного из вышеуказанных кофакторов на другой[16]. Такое передвижение обусловлено туннельным эффектом, который действует на расстояниях до 1,4 × 10−9 м[17].
Эукариотические ЭТЦ
Многие катаболические процессы, в частности, гликолиз, цикл трикарбоновых кислот и β-окисление, сопровождаются восстановлением кофермента NADH. Содержащиеся в нём электроны имеют высокий потенциал переноса, иными словами, при окислении они высвобождают большое количество энергии. Однако клетка не извлекает из них всю энергию единовременно, такая реакция была бы неконтролируемой. Вместо этого электроны отрываются от NADH и доходят до кислорода через серию ферментов, при этом при переходе на каждый из них выделяется небольшое количество энергии. Эти ферменты, составляющие комплексы I—IV ЭТЦ, расположены на внутренней митохондриальной мембране. В ЭТЦ также окисляется сукцинат, однако он включается в окислительное фосфорилирование в другой точке.
У эукариот ферменты этой электроно-транспортной системы используют энергию, выделяющуюся при окислении НАДН, для «накачивания» протонов через внутреннюю митохондриальную мембрану в межмембранное пространство. Накопление протонов в межмембранном пространстве создаёт электрохимический градиент, и заключённая в нём энергия далее используется АТФ-синтазой для синтеза АТФ. Окислительное фосфорилирование в митохондриях эукариот изучено наиболее хорошо. Митохондрии имеются у практически всех эукариот, исключение составляет анаэробное простейшее Trichomonas vaginalis, которая вместо окислительного фосфорилирования осуществляет восстановление протонов до водорода в видоизменённых митохондриях — гидрогеносомах[18].
Ниже охарактеризованы наиболее типичные дыхательные ферменты и субстраты эукариот. Стандартный электродный потенциал показывает, сколько энергии выделяется при окислении или восстановлении данного вещества, причём восстановители имеют отрицательный потенциал, а окислители — положительный.
| Дыхательный фермент | Окислительно-восстановительная пара | Стандартный электродный потенциал
(вольт) |
|---|---|---|
| НАДН-дегидрогеназа | НАД+ / НАДН | −0,32[19] |
| Сукцинатдегидрогеназа | ФМН или ФАД / FMNH2 или FADH2 | −0,20[19] |
| Комплекс цитохром-bc1[en] | Кофермент Q10окисленный / Кофермент Q10восстановленный | +0,06[19] |
| Комплекс цитохром-bc1 | Цитохром b[en]окисленный / Цитохром bвосстановленный | +0,12[19] |
| Комплекс IV | Цитохром cокисленный / Цитохром cвосстановленный | +0,22[19] |
| Комплекс IV | Цитохром a[en]окисленный / Цитохром aвосстановленный | +0,29[19] |
| Комплекс IV | O2 / HO− | +0,82[19] |
| Условия: pH = 7[19] | ||
НАДН-убихинон-оксидоредуктаза (комплекс I)
НАДН-убихинон-оксидоредуктаза, также известная как НАДН-дегидрогеназа или комплекс I, является первым белком ЭТЦ[20]. Комплекс I представляет собой очень крупный фермент, у млекопитающих он состоит из 46 субъединиц и имеет молекулярную массу свыше 1000 килодальтон (кДа)[21]. Детально структура этого комплекса изучена лишь у бактерий[22][23]; у более сложных организмов он, по-видимому, по внешнему виду напоминает сапог с большой выдающейся из мембраны частью[24]. Гены, кодирующие отдельные белки этого комплекса, содержатся и в ядерном геноме, и в митохондриальном геноме, как и у многих других митохондриальных белковых комплексов.
Этот комплекс катализирует окисление НАДН с передачей двух электронов на кофермент Q10, или убихинон (Q):
- НАДН + Q + 5H+матрикс → НАД+ + QH2 + 4H+межмембранное пространство
Эта реакция, как и работа всей ЭТЦ, начинается с связывания с комплексом молекул НАД с отдачей двух электронов. Электроны поступают в комплекс через простетическую группу, присоединённую к комплексу — флавинмононуклеотид (ФМН). При получении двух электронов ФМН восстанавливается до ФМНH2. После этого электроны проходят через серию железо-серных кластеров (второй тип простетических групп, имеющихся в комплексе)[22]. В комплексе I имеются кластеры и типа [2Fe-2S], и типа [4Fe-4S].
Когда электроны проходят через этот комплекс, из матрикса в межмембранное пространство накачивается 4 протона. Конкретный механизм этого неясен, однако, по-видимому, при этом процессе происходят конформационные изменения комплекса I, благодаря которым белок связывает протоны своей частью, обращённой на внутреннюю сторону мембраны, и выпускает их в мембранное пространство[25]. В конце концов электроны проходят через цепочку железо-серных кластеров и попадают на молекулу убихинона, расположенную внутри внутренней мембраны[20]. Восстановление убихинона также приводит к образованию протонного градиента, и при образовании QH2 из матрикса в межмембранное пространство накачиваются ещё два протона.
Сукцинат-убихинон-оксидоредуктаза (комплекс II)
Сукцинат-убихинон-оксидоредуктаза, также известная как сукцинатдегидрогеназа или комплекс II, является второй точкой поступления электронов в ЭТЦ[26]. Этот фермент необычен тем, что он входит в состав как цикла трикарбоновых кислот, так и ЭТЦ. Комплекс II состоит из четырёх белковых субъединиц и связывает кофактор FAD. Кроме того, в этом комплексе имеются железо-серные кластеры и гем, которые не участвуют в транспорте электронов на убихинон, однако, по-видимому, играют важную роль в снижении образования активных форм кислорода[27][28]. Комплекс II окисляет сукцинат до фумарата с восстановлением убихинона. Так как эта реакция даёт меньше энергии, чем окисление NADH, комплекс II не осуществляет перенос протонов через мембрану и не создаёт протонного градиента.
У некоторых эукариот, например, паразитического червя Ascaris suum, функционирует фермент, схожий с комплексом II — фумаратредуктаза (менахинол: фумарат-оксидоредуктаза, или QFR), которая работает в обратном направлении и окисляет убихинол с восстановлением фумарата. Это позволяет червю выжить в анаэробных условиях толстой кишки и осуществлять анаэробное окислительное фосфорилирование с фумаратом в качестве акцептора электронов[29]. Другая необычная функция комплекса II проявляется у малярийного плазмодия Plasmodium falciparum. Здесь комплекс II функционирует как оксидаза и регенерирует убихинон, который паразит использует в необычном пути синтеза пиримидинов[30].
ETF-оксидоредуктаза
 (Электронпереносящий флавопротеин)-оксидоредуктаза (ETF-Q-оксидоредуктаза), является третьей точкой поступления электронов в ЭТЦ. Этот фермент забирает электроны с электронопереносящих флавопротеинов митохондриального матрикса и использует их для восстановления убихинона[31]. Он связывает β-окислении жирных кислот и прочие процессы с окислительным фосфорилирование. Множество ацетил-СоА-дегидрогеназ осуществляют окисление разных субстратов (например жирных кислот), перенося электроны на электронперносящий флавопротеин (ETF). ETF-дегидрогеназа в свою очередь окисляет этот белок и переносит электроны на растворённый во внутренней мембране митохондрий убихинон, восстанавливая его до убихинола, который затем поступает в дыхательную цепь переноса электронов. ETF-Q-оксидоредуктаза содержит флавин и железо-серный кластер типа [4Fe-4S], но, в отличие от других дыхательных комплексов, она прикрепляется к поверхности мембраны и не пересекает липидный бислой[32].
(Электронпереносящий флавопротеин)-оксидоредуктаза (ETF-Q-оксидоредуктаза), является третьей точкой поступления электронов в ЭТЦ. Этот фермент забирает электроны с электронопереносящих флавопротеинов митохондриального матрикса и использует их для восстановления убихинона[31]. Он связывает β-окислении жирных кислот и прочие процессы с окислительным фосфорилирование. Множество ацетил-СоА-дегидрогеназ осуществляют окисление разных субстратов (например жирных кислот), перенося электроны на электронперносящий флавопротеин (ETF). ETF-дегидрогеназа в свою очередь окисляет этот белок и переносит электроны на растворённый во внутренней мембране митохондрий убихинон, восстанавливая его до убихинола, который затем поступает в дыхательную цепь переноса электронов. ETF-Q-оксидоредуктаза содержит флавин и железо-серный кластер типа [4Fe-4S], но, в отличие от других дыхательных комплексов, она прикрепляется к поверхности мембраны и не пересекает липидный бислой[32].
- ETFвосстановленный + Q → ETFокисленный + QH2.
У млекопитающих этот фермент важен в β-окислении жирных кислот, катаболизме аминокислот и холина[33][34]. У растений ETF-Q-оксидоредуктаза важна для выживания во время длительного периода темноты[35].
Цитохром-bc1-комплекс (комплекс III)
Цитохром-bc1-комплекс также известна как убихинол-цитохром c-оксидоредуктаза, или просто комплекс III[36][37]. У млекопитающих этот фермент является димером, и каждая субъединица комплекса состоит из 11 белковых субъединиц, один железо-серный кластер [2Fe-2S] и три цитохрома: один цитохром с1 и два цитохрома b[en][38]. Цитохромы — это электронотранспортные белки, содержащие по крайней мере одну гемовую группу. По мере продвижения электронов по белку атомы железа в гемах переходят из восстановленного состояния (Fe2+) в окисленное (Fe3+).
Комплекс III катализирует реакцию окисления одной молекулы убихинона и восстановления двух молекул цитохрома с — гемсодержащего белка, свободно перемещающегося в митохондрии. В отличие от кофермента Q, который может переносить два электрона, цитохром с переносит только один электрон.
- QH2 + 2 цитохром сокисленный + 2H+матрикс → Q + 2 цитохром свосстановленный + 4H+межмембранное пространство
Механизм реакции комплекса III более сложен, чем у остальных комплексов, и протекает в два этапа, составляющих так называемый Q-цикл[en][39]. На первом этапе фермент связывает один восстановленный убихинон, один окисленный убихинон и один цитохром с, первый из которых — QH2 — окисляется, и один электрон переходит с него на — цитохром с. Два протона, высвобождаемые QH2, уходят в межмембранное пространство. Третьим субстратом является убихинон, который связывает второй электрон с QH2 и превращается в Q- — семихинон-радикал. Первые два субстрата покидают фермент, однако промежуточный убиполухинон остаётся связанным с ним. На втором этапе цикла происходит связывание второй молекулы QH2, которая отдаёт один свой электрон ещё одной молекуле цитохрома с, а 2 протона уходят в межмембранное пространство. Второй электрон переходит на семихинон-радикал и восстанавливает его до QH2, при этом из митохондриального матрикса берутся два протона. Этот восстановленный QH2 покидает фермент[40].
Убихинон восстанавливается на внутренней стороны мембраны и окисляется на другой, при этом происходит перенос протонов через мембрану, что создаёт протонный градиент. Двухэтапный механизм реакции, осуществляемой комплексом III, очень важен, так как он увеличивает эффективность переноса протонов. Если бы вместо Q-цикла одна молекула QH2 непосредственно отдавала свои два электрона двум молекулам цитохрома с, то эффективность была бы вполовину меньше, потому что только переносился бы один протон вместо двух на одну восстановленную молекулу цитохрома с[4].
Цитохром с-оксидаза (комплекс IV)
Цитохром с-оксидаза, также называемая комплекс IV, является последним белковым комплексом ЭТЦ[41]. У млекопитающих этот фермент имеет чрезвычайно сложную структуру и содержит 13 субъединиц, две гемовые группы, а также два атома меди, связанные остатками гистидина, метионина и глутамата. Помимо этого он взаимодействует с одним атомом магния и одним атомом цинка[42].
Комплекс IV осуществляет последнюю реакцию ЭТЦ и переносит электроны на кислород, а также накачивает 4 протона из матрикса в межмебранное пространство[43]. При этом конечный акцептор электронов — кислород — восстанавливается до воды. Накачивание протонов и потребление протонов матрикса для восстановления кислорода до воды создают протонный градиент. В общем, комплекс IV катализирует реакцию окисления цитохрома с и восстановления кислорода:
- 4 Цитохром свосстановленный + О2 + 8H+ → 4 Цитохром сокисленный + 2Н2О + 4Н+.
Альтернативные редуктазы и оксидазы
Многие эукариотические организмы имеют ЭТЦ, отличные от описанной выше ЭТЦ, характерной для млекопитающих. Например, у растений имеются альтернативные NADH-редуктазы, которые окисляют NADH в цитозоле, а не в митохондриях, и переносят эти электроны непосредственно на убихиноны[44]. Эти ферменты не перекачивают протоны, поэтому они восстанавливают убихинон без изменения электрохимического градиента митохондриальной мембраны[45]. У растений, а также некоторых грибов, протистов и, возможно, некоторых животных имеется альтернативная оксидаза, переносящая электроны непосредственно с убихинола на кислород[46][47][48].
Механизмы транспорта электронов, в которых задействованы эти альтернативные НАДН-редуктазы и оксидазы, имеют меньший выход АТФ по сравнению с полной ЭТЦ. Преимущества такого укорочения пути переноса электронов не в полной мере ясны. Однако известно, что альтерантивная оксидаза образуется в ответ на стрессовые условия: холод, образование активных форм кислорода, инфекция и другие, которые подавляют работу полной ЭТЦ[49][50]. Поэтому альтернативные механизмы могут повышать устойчивость организма к неблагоприятным воздействиям, уменьшая окислительный стресс[51].
Организация комплексов
Согласно первоначальной модели ЭТЦ, дыхательные комплексы располагаются в митохондриальной мембране свободно и независимо друг от друга[52]. Тем не менее, современные данные показывают, что дыхательные комплексы формируют суперкомплексы более высокого порядка — респирасомы[53]. Согласно этой модели, дыхательные комплексы организованы в набор взаимодействующих друг с другом ферментов[54]. Эти взаимодействия дают возможность для обмена субстратами между различными ферментными комплексами, что увеличивает скорость и эффективность переноса электронов[55]. В суперкомплексах млекопитающих некоторые компоненты присутствуют в большем числе, чем другие, и, согласно некоторым данным, отношение между количеством комплексов I/II/III/IV и АТФ-синтазы составляет примерно 1:1:3:7:4[56]. Однако споры относительно справедливости такой модели не утихают, и некоторые данные не согласуются с ней[21][57].
Прокариотические ЭТЦ
В отличие от общности строения и функций эукариотических ЭТЦ, бактерии и археи демонстрируют большое разнообразие электронопереносящих ферментов, которые используют в качестве субстратов самые разнообразные химические вещества[58]. Как и у эукариот, в прокариотических ЭТЦ энергия, выделяющаяся при окислении субстрата, используется для накачивания ионов через мембрану и создания электрохимического градиента. Среди бактерий окислительное фосфорилирование наиболее хорошо изучено у Escherichia coli, в то время как ЭТЦ архей ещё изучены слабо[59].
Главное различие между ЭТЦ эукариот и прокариот заключается в том, что бактерии и археи используют множество различных субстратов в качестве доноров и акцепторов электронов, что позволяет им выживать в самых разнообразных условиях[60]. Разнообразие дыхательных субстратов E. coli представлено в таблице ниже.
| Дыхательный фермент | Окислительно-восстановительная пара | Стандартный электродный потенциал
(вольт) |
|---|---|---|
| Формиатдегидрогеназа[en] | Бикарбонат / Формиат | |
| Гидрогеназа[en] | Протон / Водород | |
| НАДН-дегидрогеназа | NAD+ / NADH | |
| Глицерол-3-фосфатдегидрогеназа[en] | Дигидроксиацетонфосфат / Глицерол-3-фосфат[en] | |
| Пируватоксидаза | Ацетат + СО2 / Пируват | |
| Лактатдегидрогеназа | Пируват / Лактат | |
| Дегидрогеназа D-аминокислот[en] | 2-оксокислота[en] + аммиак / D-аминокислота | |
| Глюкозодегидрогеназа[en] | Глюконат / Глюкоза | |
| Сукцинатдегидрогеназа | Фумарат / Сукцинат | |
| Убихинолоксидаза[en] | Кислород / Вода | |
| Нитратредуктаза[en] | Нитрат / Нитрит | |
| Нитритредуктаза | Нитрит / Аммиак | |
| Диметилсульфоксидредуктаза[en] | Диметилсульфоксид / Диметилсульфид | |
| Триметиламин-N-оксидредуктаза[en] | Триметиламин-N-оксид / Триметиламин | |
| Фумаратредуктаза | Фумарат / Сукцинат | |
Как показано выше, E. coli может расти на таких восстановительных агентах (донорах электронов), как формиат, водород, лактат, а в качестве акцепторов она может использовать нитрат, диметилсульфоксид и кислород. Чем больше разность между стандартными электродными потенциалами окислителя и восстановителя, тем больше энергии выделяется при их взаимодействии. Среди этих соединений необычной является пара сукцинат/фумарат, так как у неё стандартный электродный потенциал близок к нулю. Поэтому сукцинат может быть окислен в фумарат при наличии сильного окисляющего агента, например, кислорода, а фумарат может восстановиться в сукцинат при наличии сильного восстановителя, такого как формиат. Эти альтернативные реакции катализируются сукцинатдегидрогеназой и фумаратредуктазой соответственно[62].
Некоторые прокариоты используют только окислительно-восстановительные пары, в которых невелика разница между стандартными электродными потенциалами. В частности, нитрифицирующие бактерии, например, Nitrobacter[en], окисляют нитрит до нитрата, передавая электроны на кислород. Небольшого количества энергии, выделяемого в этой реакции, достаточно для накачивания протонов и образования АТР, но недостаточно для синтеза NADH или NADPH, которые затем могли бы быть использованы в анаболизме[63]. Эта проблема решается ферментом нитритоксидоредуктазой[en], которая обеспечивает достаточную протонодвижущую силу, чтобы электроны пошли по ЭТЦ в обратном направлении, и комплекс I в конце синтезировал NADH[64][65].
Прокариоты контролируют использование тех или иных доноров и акцепторов электронов, изменяя образование соответствующих ферментов в ответ на окружающие условия[66]. Такие гибкие изменения возможны благодаря тому, что различные оксидазы и редуктазы используют один и тот же фонд убихинона. Это даёт возможность ферментам работать совместно, будучи связанными общим промежуточным соединением — убихинолом[61]. Таким образом, дыхательные цепи прокариот имеют модульное строение[en] с легко заменяющими друг друга наборами ферментов.
Помимо этого метаболического разнообразия, прокариоты также имеют широкий спектр изоферментов — различных (то есть кодируемых разными генами) ферментов, которые катализируют одну и ту же реакцию. Так, у E. coli функционируют убихинолоксидазы двух различных типов, использующие кислород в качестве акцептора электронов. В сильно аэробных условиях бактерия использует убихинолоксидазу, имеющую небольшое сродство к кислороду и способную перекачивать два протона на электрон. Однако при снижении уровня кислорода, бактерия переключается на оксидазу, перекачивающую только один протон на электрон, однако имеющую высокое сродство к кислороду[67].
АТФ-синтаза
АТФ-синтаза, также известная как комплекс V, является конечным ферментом окислительного фосфорилирования. Этот фермент имеется у всех форм жизни и функционирует одинаково и у прокариот, и у эукариот[68]. Этот фермент использует энергию, заключённую в мембранном протонном градиенте, для синтеза АТФ из АДФ и неорганического фосфата (Pi). По разным оценкам, для синтеза одной молекулы АТФ необходима энергия от 3 до 4 протонов[69][70] , и, возможно, клетка может изменять это число в зависимости от условий[71].
- АДФ + Pi + 4H+межмембранное пространство ⇌ ATP + 4H2O + 4H+матрикс
Эта реакция фосфорилирования находится в равновесии, которое может быть сдвинуто при изменении протонодвижущей силы. В отсутствие протонодвижущей силы реакция будет идти справа налево, АТФ будет гидролизоваться, а протоны — накачиваться из матрикса в межмембранное пространство. При большом значении протонодвижущей силы реакция, напротив, пойдёт слева направо, позволяя протонам двигаться по градиенту и синтезируя АТФ из АДФ и фосфата[68]. В самом деле, близкородственная АТФ-синтазе вакуолярная Н+-ATPаза[en] использует гидролиз АТФ для накачивания протонов, а значит, и закисления определённых клеточных компартментов[72].
АТФ-синтаза представляет собой крупный белковый комплекс грибовидной формы. У млекопитающих в его состав входят 16 субъединиц, и он имеет массу около 600 кДа[73]. Часть фермента, расположенная внутри мембраны, обозначается FO и состоит из организованных в кольцо субъединиц и протонного канала. «Стебелёк» и «головка», выдающиеся в матрикс, обозначаются F1, в них происходит синтез АТФ. Шаровидная «головка» на конце F1 состоит из шести белков двух различных типов (три α-субъединицы и три β-субъединицы)[74]. И α-, и β-субъединицы могут связывать нуклеотиды, но лишь β-субъединица может катализировать синтез АТФ. «Головку» и внутримембранную часть фермента соединяет длинная палочковидная γ-субъединица.
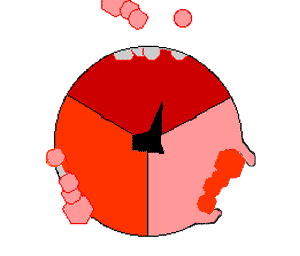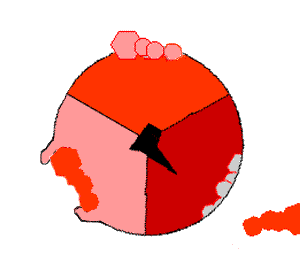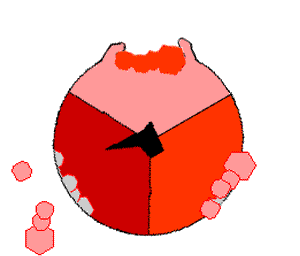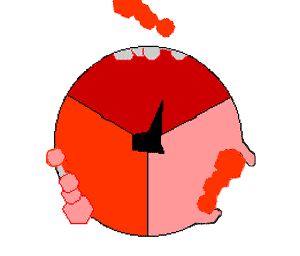 Когда протоны входят в мембрану через канал в АТФ-синтазе, FO начинает вращаться[75]. Вращение может быть обусловлено изменением ионизации аминокислот в кольце с-субъединиц, что порождает электростатические взаимодействия, вызывающие вращение кольца[76]. Вращающееся кольцо приводит во вращение центральную ось фермента (стебелёк из γ-субъединиц) с α- и β-субъединицами. Однако α- и β-субъединиц сами препятствуют своему вращению, действуя как статор по отношению к «стебельку». Это вращение конца γ-субъединиц в шарике из α- и β-субъединиц обеспечивает энергией активные центры β-субъединиц, которые подвергаются циклу изменений, в результате которых образуется и высвобождается АТФ[77].
Когда протоны входят в мембрану через канал в АТФ-синтазе, FO начинает вращаться[75]. Вращение может быть обусловлено изменением ионизации аминокислот в кольце с-субъединиц, что порождает электростатические взаимодействия, вызывающие вращение кольца[76]. Вращающееся кольцо приводит во вращение центральную ось фермента (стебелёк из γ-субъединиц) с α- и β-субъединицами. Однако α- и β-субъединиц сами препятствуют своему вращению, действуя как статор по отношению к «стебельку». Это вращение конца γ-субъединиц в шарике из α- и β-субъединиц обеспечивает энергией активные центры β-субъединиц, которые подвергаются циклу изменений, в результате которых образуется и высвобождается АТФ[77].
Реакция синтеза АТФ включает циклические изменения в активных центрах α- и β-субъединиц, которые могут находиться в трёх, циклически сменяющих друг друга положениях[78]. В «открытом» положении АДФ и фосфат входят в активный центр (коричневый сектор на диаграмме справа). Затем белок «закрывается» над молекулами и связывается с ними за счёт слабых взаимодействий («слабое» состояние, красный сектор на диаграмме). После этого фермент снова изменяет свою конформацию и сближает молекулы АДФ и фосфат друг с другом, и активный центр переходит в «плотное» состояние (розовый сектор) и связывает с большим сродством новообразованную молекулу АТФ. Наконец, активные центры возвращаются в исходное состояние, высвобождая АТФ и связывая новую порцию АДФ и фосфата.
У некоторых бактерий и архей синтез АТФ запускается перемещением ионов натрия через клеточную мембрану, а не движением протонов[79][80]. Некоторые археи, такие как Methanococcus[en], содержат A1Ao-синтазу — форму фермента, содержащую дополнительные белковые субъединицы, по последовательности аминокислот напоминающие некоторые субъединицы бактериальных и эукариотических АТФ-синтаз. Возможно, у некоторых видов A1Ao-форма фермента является специализированной натриевой АТФ-синтазой[81], однако это может не быть верным во всех случаях[80].
Активные формы кислорода
Молекулярный кислород является идеальным конечным акцептором электронов как сильный окисляющий агент. Восстановление кислорода, однако, включает образование потенциально опасных промежуточных соединений[82]. Хотя перенос четырёх электронов и четырёх протонов восстанавливает кислород до безвредной воды, однако перенос одного или двух электронов превращает кислород в супероксидный или пероксидный анион соответственно, которые чрезвычайно опасны из-за своей активности. Такие активные формы кислорода и продукты их реакций, таки как гидроксильный радикал, очень опасны для клетки, так как они окисляют белки и вызывают мутации в ДНК. Такие клеточные повреждения приводят к болезням и предположительно являются одной из причин старения[83][84].
Цитохром с-оксидазный комплекс очень эффективен в восстановлении кислорода до воды, и при его работе образуется очень мало не полностью окисленных промежуточных соединений. Однако при работе ЭТЦ всё же образуются небольшие количества супероксида и пероксида[85]. Особое значение имеет восстановление кофермента Q комплексом III, поскольку в качестве промежуточного продукта в ходе Q-цикла образуется крайне активный убиполухиноновый свободный радикал. Эта нестабильная форма кислорода может привести к «утечке» электронов непосредственно на кислород с образованием супероксида[86]. Так как образование активных форм кислорода этими протонными помпами наиболее велика при высоких значениях мембранного потенциала, поэтому было высказано предположение, что митохондрия регулирует свою активность, поддерживая значение своего мембранного потенциала в узких пределах, держащих баланс между образованием АТР и оксидантов[87]. Так, оксиданты могут активировать разобщающие белки, снижающие мембранный потенциал[88].
Для противодействия активным формам кислорода в клетке имеется множество антиоксидантных систем, в число которых входят и антиоксидантные витамины, например, витамин С и витамин Е, а также антиоксидантные ферменты: супероксиддисмутаза, каталаза, пероксидазы[en][82], которые обезвреживают активные формы кислорода и устраняют опасность для клетки.
Ингибиторы
Существует несколько хорошо известных биологически активных веществ и токсинов, ингибирующих окислительное фосфорилирование. Хотя любой из этих токсинов подавляет только один фермент ЭТЦ, ингибирование одной стадии подавляет весь процесс. Например, если олигомицин[en] подавляет АТР-синтазу, протоны не могут вернуться назад в митохондриальный матрикс[89]. В результате протонные помпы не могут работать, так как градиент становится слишком высок и они не могут его преодолеть. NADH перестаёт окисляться, из-за чего прекращается работа цикла трикарбоновых кислот: концентрация NAD+ становится слишком низкой для работы его ферментов. Ниже в таблице представлены другие блокаторы окислительного фосфорилирования:
| Соединения | Применение | Действие на окислительное фосфорилирование |
|---|---|---|
| Цианиды Угарный газ Азиды Сероводород |
Яды | Подавляют ЭТЦ, связываяь с Fe-Cu-центром в цитохром с-оксидазе сильнее кислорода и предотвращая тем самым его восстановление[90]. |
| Олигомицин | Антибиотик | Ингибирует АТР-синтазу, блокируя ток протонов через субъединицу Fo[89]. |
| Карбонилцианид-m-хлорфенилгидразон[en] 2,4-динитрофенол[en] |
Яды | Ионофоры, разрушающие протонный градиент, перенося протоны через мембрану и тем самым отделяя закачивание протонов в межмембранное пространство от синтеза АТР[91]. |
| Ротенон | Пестицид | Ингибирует перенос электронов от комплекса I на убихинон, блокируя сайт связывания убихинона[92]. |
| Малонаты и оксалоацетат | Конкурирующие ингибиторы сукцинатдегидрогеназы (комплекс II)[93]. |
Не все ингибиторы окислительного фосфорилирования являются токсинами. В бурой жировой ткани регулируемые протонные каналы, называемые разъединяющими белками, могут отделять дыхание от синтеза АТР[94]. При таком ускоренном варианте клеточного дыхания выделяется тепло, что особенно важно как путь поддержания температуры тела у животных, находящихся в спячке, хотя эти белки могут иметь и более общий эффект в клеточном ответе на стресс[95].
История
Путь к открытию окислительного фосфорилирования начался в 1906 году с открытия Артуром Харденом важнейшей роли фосфата в клеточном брожении, однако сначала такая роль была установлена только для фосфатов сахаров[96]. Однако в начале 1940-х Герман Калькар установил прочную связь между окислением сахаров и образованием АТР[97], тем самым подтверждая центральную роль АТР в энергетическом обмене, предположенную Фрицем Альбертом Липманом в 1941 году[98]. Позднее, в 1949 году Моррис Фридкин (англ. Morris Friedkin) и Альберт Ленинджер установили, что кофермент NADH связан с такими метаболическими процессами, как цикл трикарбоновых кислот и образование АТР[99].
В течение последующих двадцати лет механизм образования АТР оставался тайной, и учёные искали неуловимое «высокоэнергетичное» соединение, которое связывало бы реакции окисления и фосфорилирования[100]. Эта загадка была решена Питером Дениссом Митчеллом, опубликовавшим в 1961 году свою теорию хемиосмоса[101]. Сначала эта модель вызвала множество споров, однако постепенно она была принята, и в 1978 году Митчелл был удостоен Нобелевской премии[102][13]. Последующие исследования были направлены на выделение и описание ферментов, участвующих в окислительном фосфорилировании, и наибольший вклад в это был внесён Дэвидом Грином, описавшим комплексы ЭТЦ, и Эфраимом Рэкером[en], открывшим АТР-синтазу[103]. Окончательную разгадку механизма работы АТР-синтазы нашёл Пол Бойер, в 1973 году предложивший циклический механизм работы АТР-синтазы, а в 1982 году объяснивший механизм вращения Fo-субъединицы фермента[78][104]. Более недавние работы по изучению окислительного фосфорилирования представляют изучение структуры ферментов пути методом рентгеноструктурного анализа, осуществлённое Джоном Эрнстом Уокером, и в 1997 году Бойер и Уокер были удостоены Нобелевской премии[105].
Напишите отзыв о статье "Окислительное фосфорилирование"
Примечания
- ↑ Северин, 2011, с. 264.
- ↑ Mitchell P., Moyle J. [www.ncbi.nlm.nih.gov/pubmed/4291593 Chemiosmotic hypothesis of oxidative phosphorylation.] (англ.) // Nature. — 1967. — Vol. 213, no. 5072. — P. 137—139. — PMID 4291593.
- ↑ 1 2 Dimroth P., Kaim G., Matthey U. [www.ncbi.nlm.nih.gov/pubmed/10600673 Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases.] (англ.) // The Journal of experimental biology. — 2000. — Vol. 203, no. Pt 1. — P. 51—59. — PMID 10600673.
- ↑ 1 2 3 Schultz B. E., Chan S. I. [www.ncbi.nlm.nih.gov/pubmed/11340051 Structures and proton-pumping strategies of mitochondrial respiratory enzymes.] (англ.) // Annual review of biophysics and biomolecular structure. — 2001. — Vol. 30. — P. 23—65. — DOI:10.1146/annurev.biophys.30.1.23. — PMID 11340051.
- ↑ Nelson, Cox, 2008, p. 723—724.
- ↑ Rich P. R. [www.ncbi.nlm.nih.gov/pubmed/14641005 The molecular machinery of Keilin's respiratory chain.] (англ.) // Biochemical Society transactions. — 2003. — Vol. 31, no. Pt 6. — P. 1095—1105. — DOI:10.1042/. — PMID 14641005.
- ↑ Porter R. K., Brand M. D. [www.ncbi.nlm.nih.gov/pubmed/7654171 Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes.] (англ.) // The Biochemical journal. — 1995. — Vol. 310 ( Pt 2). — P. 379—382. — PMID 7654171.
- ↑ Vander Heiden M. G., Cantley L. C., Thompson C. B. [www.ncbi.nlm.nih.gov/pubmed/19460998 Understanding the Warburg effect: the metabolic requirements of cell proliferation.] (англ.) // Science (New York, N.Y.). — 2009. — Vol. 324, no. 5930. — P. 1029—1033. — DOI:10.1126/science.1160809. — PMID 19460998.
- ↑ [www.nature.com/cddis/journal/v4/n3/fig_tab/cddis201360b1.html The Warburg effect and cancer.].
- ↑ [www.ncbi.nlm.nih.gov/pubmed/3881803 ]. — PMID 3881803.
- ↑ Wood P. M. [www.ncbi.nlm.nih.gov/pubmed/6317447 Why do c-type cytochromes exist?] (англ.) // FEBS letters. — 1983. — Vol. 164, no. 2. — P. 223—226. — PMID 6317447.
- ↑ Crane F. L. [www.ncbi.nlm.nih.gov/pubmed/11771674 Biochemical functions of coenzyme Q10.] (англ.) // Journal of the American College of Nutrition. — 2001. — Vol. 20, no. 6. — P. 591—598. — PMID 11771674.
- ↑ 1 2 Mitchell P. [www.ncbi.nlm.nih.gov/pubmed/388618 Keilin's respiratory chain concept and its chemiosmotic consequences.] (англ.) // Science (New York, N.Y.). — 1979. — Vol. 206, no. 4423. — P. 1148—1159. — PMID 388618.
- ↑ [www.ncbi.nlm.nih.gov/pubmed/10463148 ]. — PMID 10463148.
- ↑ Johnson D. C., Dean D. R., Smith A. D., Johnson M. K. [www.ncbi.nlm.nih.gov/pubmed/15952888 Structure, function, and formation of biological iron-sulfur clusters.] (англ.) // Annual review of biochemistry. — 2005. — Vol. 74. — P. 247—281. — DOI:10.1146/annurev.biochem.74.082803.133518. — PMID 15952888.
- ↑ [www.ncbi.nlm.nih.gov/pubmed/10573417 ]. — PMID 10573417.
- ↑ Leys D., Scrutton N. S. [www.ncbi.nlm.nih.gov/pubmed/15582386 Electrical circuitry in biology: emerging principles from protein structure.] (англ.) // Current opinion in structural biology. — 2004. — Vol. 14, no. 6. — P. 642—647. — DOI:10.1016/j.sbi.2004.10.002. — PMID 15582386.
- ↑ Boxma B., de Graaf R. M., van der Staay G. W., van Alen T. A., Ricard G., Gabaldón T., van Hoek A. H., Moon-van der Staay S. Y., Koopman W. J., van Hellemond J. J., Tielens A. G., Friedrich T., Veenhuis M., Huynen M. A., Hackstein J. H. [www.ncbi.nlm.nih.gov/pubmed/15744302 An anaerobic mitochondrion that produces hydrogen.] (англ.) // Nature. — 2005. — Vol. 434, no. 7029. — P. 74—79. — DOI:10.1038/nature03343. — PMID 15744302.
- ↑ 1 2 3 4 5 6 7 8 Anders Overgaard Pedersen, Henning Nielsen. Medical CHEMISTRY Compendium.. — Aarhus University, 2008.
- ↑ 1 2 Hirst J. [www.ncbi.nlm.nih.gov/pubmed/15916556 Energy transduction by respiratory complex I--an evaluation of current knowledge.] (англ.) // Biochemical Society transactions. — 2005. — Vol. 33, no. Pt 3. — P. 525—529. — DOI:10.1042/BST0330525. — PMID 15916556.
- ↑ 1 2 Lenaz G., Fato R., Genova M. L., Bergamini C., Bianchi C., Biondi A. [www.ncbi.nlm.nih.gov/pubmed/16828051 Mitochondrial Complex I: structural and functional aspects.] (англ.) // Biochimica et biophysica acta. — 2006. — Vol. 1757, no. 9-10. — P. 1406—1420. — DOI:10.1016/j.bbabio.2006.05.007. — PMID 16828051.
- ↑ 1 2 Sazanov L. A., Hinchliffe P. [www.ncbi.nlm.nih.gov/pubmed/16469879 Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus.] (англ.) // Science (New York, N.Y.). — 2006. — Vol. 311, no. 5766. — P. 1430—1436. — DOI:10.1126/science.1123809. — PMID 16469879.
- ↑ Efremov R. G., Baradaran R., Sazanov L. A. [www.ncbi.nlm.nih.gov/pubmed/20505720 The architecture of respiratory complex I.] (англ.) // Nature. — 2010. — Vol. 465, no. 7297. — P. 441—445. — DOI:10.1038/nature09066. — PMID 20505720.
- ↑ Friedrich T., Böttcher B. [www.ncbi.nlm.nih.gov/pubmed/14741580 The gross structure of the respiratory complex I: a Lego System.] (англ.) // Biochimica et biophysica acta. — 2004. — Vol. 1608, no. 1. — P. 1—9. — PMID 14741580.
- ↑ Hirst J. [www.ncbi.nlm.nih.gov/pubmed/20025615 Towards the molecular mechanism of respiratory complex I.] (англ.) // The Biochemical journal. — 2009. — Vol. 425, no. 2. — P. 327—339. — DOI:10.1042/BJ20091382. — PMID 20025615.
- ↑ Cecchini G. [www.ncbi.nlm.nih.gov/pubmed/14527321 Function and structure of complex II of the respiratory chain.] (англ.) // Annual review of biochemistry. — 2003. — Vol. 72. — P. 77—109. — DOI:10.1146/annurev.biochem.72.121801.161700. — PMID 14527321.
- ↑ Yankovskaya V., Horsefield R., Törnroth S., Luna-Chavez C., Miyoshi H., Léger C., Byrne B., Cecchini G., Iwata S. [www.ncbi.nlm.nih.gov/pubmed/12560550 Architecture of succinate dehydrogenase and reactive oxygen species generation.] (англ.) // Science (New York, N.Y.). — 2003. — Vol. 299, no. 5607. — P. 700—704. — DOI:10.1126/science.1079605. — PMID 12560550.
- ↑ Horsefield R., Iwata S., Byrne B. [www.ncbi.nlm.nih.gov/pubmed/15078221 Complex II from a structural perspective.] (англ.) // Current protein & peptide science. — 2004. — Vol. 5, no. 2. — P. 107—118. — PMID 15078221.
- ↑ Kita K., Hirawake H., Miyadera H., Amino H., Takeo S. [www.ncbi.nlm.nih.gov/pubmed/11803022 Role of complex II in anaerobic respiration of the parasite mitochondria from Ascaris suum and Plasmodium falciparum.] (англ.) // Biochimica et biophysica acta. — 2002. — Vol. 1553, no. 1-2. — P. 123—139. — PMID 11803022.
- ↑ [www.ncbi.nlm.nih.gov/pubmed/17330044 ]. — PMID 17330044.
- ↑ Ramsay R. R., Steenkamp D. J., Husain M. [www.ncbi.nlm.nih.gov/pubmed/3593226 Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase.] (англ.) // The Biochemical journal. — 1987. — Vol. 241, no. 3. — P. 883—892. — PMID 3593226.
- ↑ Zhang J., Frerman F. E., Kim J. J. [www.ncbi.nlm.nih.gov/pubmed/17050691 Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool.] (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2006. — Vol. 103, no. 44. — P. 16212—16217. — DOI:10.1073/pnas.0604567103. — PMID 17050691.
- ↑ Ikeda Y., Dabrowski C., Tanaka K. [www.ncbi.nlm.nih.gov/pubmed/6401712 Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase.] (англ.) // The Journal of biological chemistry. — 1983. — Vol. 258, no. 2. — P. 1066—1076. — PMID 6401712.
- ↑ Ruzicka F. J., Beinert H. [www.ncbi.nlm.nih.gov/pubmed/925004 A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway.] (англ.) // The Journal of biological chemistry. — 1977. — Vol. 252, no. 23. — P. 8440—8445. — PMID 925004.
- ↑ Ishizaki K., Larson T. R., Schauer N., Fernie A. R., Graham I. A., Leaver C. J. [www.ncbi.nlm.nih.gov/pubmed/16055629 The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation.] (англ.) // The Plant cell. — 2005. — Vol. 17, no. 9. — P. 2587—2600. — DOI:10.1105/tpc.105.035162. — PMID 16055629.
- ↑ Berry E. A., Guergova-Kuras M., Huang L. S., Crofts A. R. [www.ncbi.nlm.nih.gov/pubmed/10966481 Structure and function of cytochrome bc complexes.] (англ.) // Annual review of biochemistry. — 2000. — Vol. 69. — P. 1005—1075. — DOI:10.1146/annurev.biochem.69.1.1005. — PMID 10966481.
- ↑ Crofts A. R. [www.ncbi.nlm.nih.gov/pubmed/14977419 The cytochrome bc1 complex: function in the context of structure.] (англ.) // Annual review of physiology. — 2004. — Vol. 66. — P. 689—733. — DOI:10.1146/annurev.physiol.66.032102.150251. — PMID 14977419.
- ↑ Iwata S., Lee J. W., Okada K., Lee J. K., Iwata M., Rasmussen B., Link T. A., Ramaswamy S., Jap B. K. [www.ncbi.nlm.nih.gov/pubmed/9651245 Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex.] (англ.) // Science (New York, N.Y.). — 1998. — Vol. 281, no. 5373. — P. 64—71. — PMID 9651245.
- ↑ Trumpower B. L. [www.ncbi.nlm.nih.gov/pubmed/2164001 The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex.] (англ.) // The Journal of biological chemistry. — 1990. — Vol. 265, no. 20. — P. 11409—11412. — PMID 2164001.
- ↑ Hunte C., Palsdottir H., Trumpower B. L. [www.ncbi.nlm.nih.gov/pubmed/12788490 Protonmotive pathways and mechanisms in the cytochrome bc1 complex.] (англ.) // FEBS letters. — 2003. — Vol. 545, no. 1. — P. 39—46. — PMID 12788490.
- ↑ Calhoun M. W., Thomas J. W., Gennis R. B. [www.ncbi.nlm.nih.gov/pubmed/7940677 The cytochrome oxidase superfamily of redox-driven proton pumps.] (англ.) // Trends in biochemical sciences. — 1994. — Vol. 19, no. 8. — P. 325—330. — PMID 7940677.
- ↑ Tsukihara T., Aoyama H., Yamashita E., Tomizaki T., Yamaguchi H., Shinzawa-Itoh K., Nakashima R., Yaono R., Yoshikawa S. [www.ncbi.nlm.nih.gov/pubmed/8638158 The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A.] (англ.) // Science (New York, N.Y.). — 1996. — Vol. 272, no. 5265. — P. 1136—1144. — PMID 8638158.
- ↑ Yoshikawa S., Muramoto K., Shinzawa-Itoh K., Aoyama H., Tsukihara T., Shimokata K., Katayama Y., Shimada H. [www.ncbi.nlm.nih.gov/pubmed/16904626 Proton pumping mechanism of bovine heart cytochrome c oxidase.] (англ.) // Biochimica et biophysica acta. — 2006. — Vol. 1757, no. 9-10. — P. 1110—1116. — DOI:10.1016/j.bbabio.2006.06.004. — PMID 16904626.
- ↑ Rasmusson A. G., Soole K. L., Elthon T. E. [www.ncbi.nlm.nih.gov/pubmed/15725055 Alternative NAD(P)H dehydrogenases of plant mitochondria.] (англ.) // Annual review of plant biology. — 2004. — Vol. 55. — P. 23—39. — DOI:10.1146/annurev.arplant.55.031903.141720. — PMID 15725055.
- ↑ Menz R. I., Day D. A. [www.ncbi.nlm.nih.gov/pubmed/8798503 Purification and characterization of a 43-kDa rotenone-insensitive NADH dehydrogenase from plant mitochondria.] (англ.) // The Journal of biological chemistry. — 1996. — Vol. 271, no. 38. — P. 23117—23120. — PMID 8798503.
- ↑ McDonald A., Vanlerberghe G. [www.ncbi.nlm.nih.gov/pubmed/15370881 Branched mitochondrial electron transport in the Animalia: presence of alternative oxidase in several animal phyla.] (англ.) // IUBMB life. — 2004. — Vol. 56, no. 6. — P. 333—341. — DOI:10.1080/1521-6540400000876. — PMID 15370881.
- ↑ Sluse F. E., Jarmuszkiewicz W. [www.ncbi.nlm.nih.gov/pubmed/9698817 Alternative oxidase in the branched mitochondrial respiratory network: an overview on structure, function, regulation, and role.] (англ.) // Brazilian journal of medical and biological research = Revista brasileira de pesquisas medicas e biologicas / Sociedade Brasileira de Biofisica ... [et al.]. — 1998. — Vol. 31, no. 6. — P. 733—747. — PMID 9698817.
- ↑ Moore A. L., Siedow J. N. [www.ncbi.nlm.nih.gov/pubmed/1883834 The regulation and nature of the cyanide-resistant alternative oxidase of plant mitochondria.] (англ.) // Biochimica et biophysica acta. — 1991. — Vol. 1059, no. 2. — P. 121—140. — PMID 1883834.
- ↑ Vanlerberghe G. C., McIntosh L. [www.ncbi.nlm.nih.gov/pubmed/15012279 ALTERNATIVE OXIDASE: From Gene to Function.] (англ.) // Annual review of plant physiology and plant molecular biology. — 1997. — Vol. 48. — P. 703—734. — DOI:10.1146/annurev.arplant.48.1.703. — PMID 15012279.
- ↑ Ito Y., Saisho D., Nakazono M., Tsutsumi N., Hirai A. [www.ncbi.nlm.nih.gov/pubmed/9426242 Transcript levels of tandem-arranged alternative oxidase genes in rice are increased by low temperature.] (англ.) // Gene. — 1997. — Vol. 203, no. 2. — P. 121—129. — PMID 9426242.
- ↑ Maxwell D. P., Wang Y., McIntosh L. [www.ncbi.nlm.nih.gov/pubmed/10393984 The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells.] (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1999. — Vol. 96, no. 14. — P. 8271—8276. — PMID 10393984.
- ↑ Lenaz G. [www.ncbi.nlm.nih.gov/pubmed/11741580 A critical appraisal of the mitochondrial coenzyme Q pool.] (англ.) // FEBS letters. — 2001. — Vol. 509, no. 2. — P. 151—155. — PMID 11741580.
- ↑ Heinemeyer J., Braun H. P., Boekema E. J., Kouril R. [www.ncbi.nlm.nih.gov/pubmed/17322303 A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria.] (англ.) // The Journal of biological chemistry. — 2007. — Vol. 282, no. 16. — P. 12240—12248. — DOI:10.1074/jbc.M610545200. — PMID 17322303.
- ↑ Schägger H., Pfeiffer K. [www.ncbi.nlm.nih.gov/pubmed/10775262 Supercomplexes in the respiratory chains of yeast and mammalian mitochondria.] (англ.) // The EMBO journal. — 2000. — Vol. 19, no. 8. — P. 1777—1783. — DOI:10.1093/emboj/19.8.1777. — PMID 10775262.
- ↑ Schägger H. [www.ncbi.nlm.nih.gov/pubmed/12206908 Respiratory chain supercomplexes of mitochondria and bacteria.] (англ.) // Biochimica et biophysica acta. — 2002. — Vol. 1555, no. 1-3. — P. 154—159. — PMID 12206908.
- ↑ Schägger H., Pfeiffer K. [www.ncbi.nlm.nih.gov/pubmed/11483615 The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes.] (англ.) // The Journal of biological chemistry. — 2001. — Vol. 276, no. 41. — P. 37861—37867. — DOI:10.1074/jbc.M106474200. — PMID 11483615.
- ↑ Gupte S., Wu E. S., Hoechli L., Hoechli M., Jacobson K., Sowers A. E., Hackenbrock C. R. [www.ncbi.nlm.nih.gov/pubmed/6326133 Relationship between lateral diffusion, collision frequency, and electron transfer of mitochondrial inner membrane oxidation-reduction components.] (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1984. — Vol. 81, no. 9. — P. 2606—2610. — PMID 6326133.
- ↑ Nealson K. H. [www.ncbi.nlm.nih.gov/pubmed/11536899 Post-Viking microbiology: new approaches, new data, new insights.] (англ.) // Origins of life and evolution of the biosphere : the journal of the International Society for the Study of the Origin of Life. — 1999. — Vol. 29, no. 1. — P. 73—93. — PMID 11536899.
- ↑ Schäfer G., Engelhard M., Müller V. [www.ncbi.nlm.nih.gov/pubmed/10477309 Bioenergetics of the Archaea.] (англ.) // Microbiology and molecular biology reviews : MMBR. — 1999. — Vol. 63, no. 3. — P. 570—620. — PMID 10477309.
- ↑ Ingledew W. J., Poole R. K. [www.ncbi.nlm.nih.gov/pubmed/6387427 The respiratory chains of Escherichia coli.] (англ.) // Microbiological reviews. — 1984. — Vol. 48, no. 3. — P. 222—271. — PMID 6387427.
- ↑ 1 2 Unden G., Bongaerts J. [www.ncbi.nlm.nih.gov/pubmed/9230919 Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors.] (англ.) // Biochimica et biophysica acta. — 1997. — Vol. 1320, no. 3. — P. 217—234. — PMID 9230919.
- ↑ Cecchini G., Schröder I., Gunsalus R. P., Maklashina E. [www.ncbi.nlm.nih.gov/pubmed/11803023 Succinate dehydrogenase and fumarate reductase from Escherichia coli.] (англ.) // Biochimica et biophysica acta. — 2002. — Vol. 1553, no. 1-2. — P. 140—157. — PMID 11803023.
- ↑ Freitag A, Bock E (1990). «Energy conservation in Nitrobacter». FEMS Microbiology Letters 66 (1—3): 157—62. DOI:10.1111/j.1574-6968.1990.tb03989.x.
- ↑ Starkenburg S. R., Chain P. S., Sayavedra-Soto L. A., Hauser L., Land M. L., Larimer F. W., Malfatti S. A., Klotz M. G., Bottomley P. J., Arp D. J., Hickey W. J. [www.ncbi.nlm.nih.gov/pubmed/16517654 Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255.] (англ.) // Applied and environmental microbiology. — 2006. — Vol. 72, no. 3. — P. 2050—2063. — DOI:10.1128/AEM.72.3.2050-2063.2006. — PMID 16517654.
- ↑ Yamanaka T., Fukumori Y. [www.ncbi.nlm.nih.gov/pubmed/2856189 The nitrite oxidizing system of Nitrobacter winogradskyi.] (англ.) // FEMS microbiology reviews. — 1988. — Vol. 4, no. 4. — P. 259—270. — PMID 2856189.
- ↑ Iuchi S., Lin E. C. [www.ncbi.nlm.nih.gov/pubmed/8412675 Adaptation of Escherichia coli to redox environments by gene expression.] (англ.) // Molecular microbiology. — 1993. — Vol. 9, no. 1. — P. 9—15. — PMID 8412675.
- ↑ Calhoun M. W., Oden K. L., Gennis R. B., de Mattos M. J., Neijssel O. M. [www.ncbi.nlm.nih.gov/pubmed/8491720 Energetic efficiency of Escherichia coli: effects of mutations in components of the aerobic respiratory chain.] (англ.) // Journal of bacteriology. — 1993. — Vol. 175, no. 10. — P. 3020—3025. — PMID 8491720.
- ↑ 1 2 Boyer P. D. [www.ncbi.nlm.nih.gov/pubmed/9242922 The ATP synthase--a splendid molecular machine.] (англ.) // Annual review of biochemistry. — 1997. — Vol. 66. — P. 717—749. — DOI:10.1146/annurev.biochem.66.1.717. — PMID 9242922.
- ↑ Van Walraven H. S., Strotmann H., Schwarz O., Rumberg B. [www.ncbi.nlm.nih.gov/pubmed/8603713 The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four.] (англ.) // FEBS letters. — 1996. — Vol. 379, no. 3. — P. 309—313. — PMID 8603713.
- ↑ Yoshida M., Muneyuki E., Hisabori T. [www.ncbi.nlm.nih.gov/pubmed/11533724 ATP synthase--a marvellous rotary engine of the cell.] (англ.) // Nature reviews. Molecular cell biology. — 2001. — Vol. 2, no. 9. — P. 669—677. — DOI:10.1038/35089509. — PMID 11533724.
- ↑ Schemidt R. A., Qu J., Williams J. R., Brusilow W. S. [www.ncbi.nlm.nih.gov/pubmed/9620972 Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli.] (англ.) // Journal of bacteriology. — 1998. — Vol. 180, no. 12. — P. 3205—3208. — PMID 9620972.
- ↑ Nelson N., Perzov N., Cohen A., Hagai K., Padler V., Nelson H. [www.ncbi.nlm.nih.gov/pubmed/10600677 The cellular biology of proton-motive force generation by V-ATPases.] (англ.) // The Journal of experimental biology. — 2000. — Vol. 203, no. Pt 1. — P. 89—95. — PMID 10600677.
- ↑ Rubinstein J. L., Walker J. E., Henderson R. [www.ncbi.nlm.nih.gov/pubmed/14633978 Structure of the mitochondrial ATP synthase by electron cryomicroscopy.] (англ.) // The EMBO journal. — 2003. — Vol. 22, no. 23. — P. 6182—6192. — DOI:10.1093/emboj/cdg608. — PMID 14633978.
- ↑ Leslie A. G., Walker J. E. [www.ncbi.nlm.nih.gov/pubmed/10836500 Structural model of F1-ATPase and the implications for rotary catalysis.] (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 2000. — Vol. 355, no. 1396. — P. 465—471. — DOI:10.1098/rstb.2000.0588. — PMID 10836500.
- ↑ Noji H., Yoshida M. [www.ncbi.nlm.nih.gov/pubmed/11080505 The rotary machine in the cell, ATP synthase.] (англ.) // The Journal of biological chemistry. — 2001. — Vol. 276, no. 3. — P. 1665—1668. — DOI:10.1074/jbc.R000021200. — PMID 11080505.
- ↑ PMID 11893513 (PMID [www.ncbi.nlm.nih.gov/pubmed/11893513 11893513])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11893513&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 16607397 (PMID [www.ncbi.nlm.nih.gov/pubmed/16607397 16607397])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16607397&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ 1 2 PMID 6214554 (PMID [www.ncbi.nlm.nih.gov/pubmed/6214554 6214554])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=6214554&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 7832594 (PMID [www.ncbi.nlm.nih.gov/pubmed/7832594 7832594])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=7832594&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ 1 2 PMID 8169202 (PMID [www.ncbi.nlm.nih.gov/pubmed/8169202 8169202])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=8169202&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 15168615 (PMID [www.ncbi.nlm.nih.gov/pubmed/15168615 15168615])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=15168615&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ 1 2 PMID 8660387 (PMID [www.ncbi.nlm.nih.gov/pubmed/8660387 8660387])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=8660387&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 17090411 (PMID [www.ncbi.nlm.nih.gov/pubmed/17090411 17090411])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=17090411&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 16978905 (PMID [www.ncbi.nlm.nih.gov/pubmed/16978905 16978905])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16978905&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 11050436 (PMID [www.ncbi.nlm.nih.gov/pubmed/11050436 11050436])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11050436&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 11089981 (PMID [www.ncbi.nlm.nih.gov/pubmed/11089981 11089981])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11089981&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 19409964 (PMID [www.ncbi.nlm.nih.gov/pubmed/19409964 19409964])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=19409964&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 11780125 (PMID [www.ncbi.nlm.nih.gov/pubmed/11780125 11780125])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=11780125&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ 1 2 PMID 1831660 (PMID [www.ncbi.nlm.nih.gov/pubmed/1831660 1831660])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=1831660&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 8380331 (PMID [www.ncbi.nlm.nih.gov/pubmed/8380331 8380331])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=8380331&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 156853 (PMID [www.ncbi.nlm.nih.gov/pubmed/156853 156853])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=156853&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 15262965 (PMID [www.ncbi.nlm.nih.gov/pubmed/15262965 15262965])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=15262965&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 14249115 (PMID [www.ncbi.nlm.nih.gov/pubmed/14249115 14249115])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=14249115&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 10620491 (PMID [www.ncbi.nlm.nih.gov/pubmed/10620491 10620491])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=10620491&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 16283557 (PMID [www.ncbi.nlm.nih.gov/pubmed/16283557 16283557])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=16283557&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ Harden A, Young WJ. (1906). «The alcoholic ferment of yeast-juice». Proceedings of the Royal Society B (77): 405–20. DOI:10.1098/rspb.1906.0029.
- ↑ PMID 4279328 (PMID [www.ncbi.nlm.nih.gov/pubmed/4279328 4279328])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=4279328&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ Lipmann F, (1941). «Metabolic generation and utilization of phosphate bond energy». Adv Enzymol 1: 99–162.
- ↑ PMID 18116985 (PMID [www.ncbi.nlm.nih.gov/pubmed/18116985 18116985])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=18116985&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 13111237 (PMID [www.ncbi.nlm.nih.gov/pubmed/13111237 13111237])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=13111237&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 13771349 (PMID [www.ncbi.nlm.nih.gov/pubmed/13771349 13771349])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=13771349&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ Milton H. Saier Jr. [www.worldcat.org/title/peter-mitchell-and-the-vital-force/oclc/55202414 Peter Mitchell and the Vital Force]. Проверено 22 января 2015.
- ↑ PMID 13738472 (PMID [www.ncbi.nlm.nih.gov/pubmed/13738472 13738472])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=13738472&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ PMID 4517936 (PMID [www.ncbi.nlm.nih.gov/pubmed/4517936 4517936])
Библиографическое описание появится автоматически через некоторое время. Вы можете подставить цитату вручную или используя [tools.wmflabs.org/citing-bot/pmid.php?page=4517936&page_out=%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5+%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5 бота]. - ↑ [nobelprize.org/nobel_prizes/chemistry/laureates/1997/ The Nobel Prize in Chemistry 1997]. Nobel Foundation. Проверено 22 января 2015.
Литература
- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells.. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Campbell N. A., Reece J. B., Urry L. A. e. a. Biology. 9th ed. — Benjamin Cummings, 2011. — 1263 p. — ISBN 978-0-321-55823-7.
- Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
Отрывок, характеризующий Окислительное фосфорилирование
С осени 1806 года опять всё заговорило о войне с Наполеоном еще с большим жаром, чем в прошлом году. Назначен был не только набор рекрут, но и еще 9 ти ратников с тысячи. Повсюду проклинали анафемой Бонапартия, и в Москве только и толков было, что о предстоящей войне. Для семейства Ростовых весь интерес этих приготовлений к войне заключался только в том, что Николушка ни за что не соглашался оставаться в Москве и выжидал только конца отпуска Денисова с тем, чтобы с ним вместе ехать в полк после праздников. Предстоящий отъезд не только не мешал ему веселиться, но еще поощрял его к этому. Большую часть времени он проводил вне дома, на обедах, вечерах и балах.ХI
На третий день Рождества, Николай обедал дома, что в последнее время редко случалось с ним. Это был официально прощальный обед, так как он с Денисовым уезжал в полк после Крещенья. Обедало человек двадцать, в том числе Долохов и Денисов.
Никогда в доме Ростовых любовный воздух, атмосфера влюбленности не давали себя чувствовать с такой силой, как в эти дни праздников. «Лови минуты счастия, заставляй себя любить, влюбляйся сам! Только это одно есть настоящее на свете – остальное всё вздор. И этим одним мы здесь только и заняты», – говорила эта атмосфера. Николай, как и всегда, замучив две пары лошадей и то не успев побывать во всех местах, где ему надо было быть и куда его звали, приехал домой перед самым обедом. Как только он вошел, он заметил и почувствовал напряженность любовной атмосферы в доме, но кроме того он заметил странное замешательство, царствующее между некоторыми из членов общества. Особенно взволнованы были Соня, Долохов, старая графиня и немного Наташа. Николай понял, что что то должно было случиться до обеда между Соней и Долоховым и с свойственною ему чуткостью сердца был очень нежен и осторожен, во время обеда, в обращении с ними обоими. В этот же вечер третьего дня праздников должен был быть один из тех балов у Иогеля (танцовального учителя), которые он давал по праздникам для всех своих учеников и учениц.
– Николенька, ты поедешь к Иогелю? Пожалуйста, поезжай, – сказала ему Наташа, – он тебя особенно просил, и Василий Дмитрич (это был Денисов) едет.
– Куда я не поеду по приказанию г'афини! – сказал Денисов, шутливо поставивший себя в доме Ростовых на ногу рыцаря Наташи, – pas de chale [танец с шалью] готов танцовать.
– Коли успею! Я обещал Архаровым, у них вечер, – сказал Николай.
– А ты?… – обратился он к Долохову. И только что спросил это, заметил, что этого не надо было спрашивать.
– Да, может быть… – холодно и сердито отвечал Долохов, взглянув на Соню и, нахмурившись, точно таким взглядом, каким он на клубном обеде смотрел на Пьера, опять взглянул на Николая.
«Что нибудь есть», подумал Николай и еще более утвердился в этом предположении тем, что Долохов тотчас же после обеда уехал. Он вызвал Наташу и спросил, что такое?
– А я тебя искала, – сказала Наташа, выбежав к нему. – Я говорила, ты всё не хотел верить, – торжествующе сказала она, – он сделал предложение Соне.
Как ни мало занимался Николай Соней за это время, но что то как бы оторвалось в нем, когда он услыхал это. Долохов был приличная и в некоторых отношениях блестящая партия для бесприданной сироты Сони. С точки зрения старой графини и света нельзя было отказать ему. И потому первое чувство Николая, когда он услыхал это, было озлобление против Сони. Он приготавливался к тому, чтобы сказать: «И прекрасно, разумеется, надо забыть детские обещания и принять предложение»; но не успел он еще сказать этого…
– Можешь себе представить! она отказала, совсем отказала! – заговорила Наташа. – Она сказала, что любит другого, – прибавила она, помолчав немного.
«Да иначе и не могла поступить моя Соня!» подумал Николай.
– Сколько ее ни просила мама, она отказала, и я знаю, она не переменит, если что сказала…
– А мама просила ее! – с упреком сказал Николай.
– Да, – сказала Наташа. – Знаешь, Николенька, не сердись; но я знаю, что ты на ней не женишься. Я знаю, Бог знает отчего, я знаю верно, ты не женишься.
– Ну, этого ты никак не знаешь, – сказал Николай; – но мне надо поговорить с ней. Что за прелесть, эта Соня! – прибавил он улыбаясь.
– Это такая прелесть! Я тебе пришлю ее. – И Наташа, поцеловав брата, убежала.
Через минуту вошла Соня, испуганная, растерянная и виноватая. Николай подошел к ней и поцеловал ее руку. Это был первый раз, что они в этот приезд говорили с глазу на глаз и о своей любви.
– Sophie, – сказал он сначала робко, и потом всё смелее и смелее, – ежели вы хотите отказаться не только от блестящей, от выгодной партии; но он прекрасный, благородный человек… он мой друг…
Соня перебила его.
– Я уж отказалась, – сказала она поспешно.
– Ежели вы отказываетесь для меня, то я боюсь, что на мне…
Соня опять перебила его. Она умоляющим, испуганным взглядом посмотрела на него.
– Nicolas, не говорите мне этого, – сказала она.
– Нет, я должен. Может быть это suffisance [самонадеянность] с моей стороны, но всё лучше сказать. Ежели вы откажетесь для меня, то я должен вам сказать всю правду. Я вас люблю, я думаю, больше всех…
– Мне и довольно, – вспыхнув, сказала Соня.
– Нет, но я тысячу раз влюблялся и буду влюбляться, хотя такого чувства дружбы, доверия, любви, я ни к кому не имею, как к вам. Потом я молод. Мaman не хочет этого. Ну, просто, я ничего не обещаю. И я прошу вас подумать о предложении Долохова, – сказал он, с трудом выговаривая фамилию своего друга.
– Не говорите мне этого. Я ничего не хочу. Я люблю вас, как брата, и всегда буду любить, и больше мне ничего не надо.
– Вы ангел, я вас не стою, но я только боюсь обмануть вас. – Николай еще раз поцеловал ее руку.
У Иогеля были самые веселые балы в Москве. Это говорили матушки, глядя на своих adolescentes, [девушек,] выделывающих свои только что выученные па; это говорили и сами adolescentes и adolescents, [девушки и юноши,] танцовавшие до упаду; эти взрослые девицы и молодые люди, приезжавшие на эти балы с мыслию снизойти до них и находя в них самое лучшее веселье. В этот же год на этих балах сделалось два брака. Две хорошенькие княжны Горчаковы нашли женихов и вышли замуж, и тем еще более пустили в славу эти балы. Особенного на этих балах было то, что не было хозяина и хозяйки: был, как пух летающий, по правилам искусства расшаркивающийся, добродушный Иогель, который принимал билетики за уроки от всех своих гостей; было то, что на эти балы еще езжали только те, кто хотел танцовать и веселиться, как хотят этого 13 ти и 14 ти летние девочки, в первый раз надевающие длинные платья. Все, за редкими исключениями, были или казались хорошенькими: так восторженно они все улыбались и так разгорались их глазки. Иногда танцовывали даже pas de chale лучшие ученицы, из которых лучшая была Наташа, отличавшаяся своею грациозностью; но на этом, последнем бале танцовали только экосезы, англезы и только что входящую в моду мазурку. Зала была взята Иогелем в дом Безухова, и бал очень удался, как говорили все. Много было хорошеньких девочек, и Ростовы барышни были из лучших. Они обе были особенно счастливы и веселы. В этот вечер Соня, гордая предложением Долохова, своим отказом и объяснением с Николаем, кружилась еще дома, не давая девушке дочесать свои косы, и теперь насквозь светилась порывистой радостью.
Наташа, не менее гордая тем, что она в первый раз была в длинном платье, на настоящем бале, была еще счастливее. Обе были в белых, кисейных платьях с розовыми лентами.
Наташа сделалась влюблена с самой той минуты, как она вошла на бал. Она не была влюблена ни в кого в особенности, но влюблена была во всех. В того, на кого она смотрела в ту минуту, как она смотрела, в того она и была влюблена.
– Ах, как хорошо! – всё говорила она, подбегая к Соне.
Николай с Денисовым ходили по залам, ласково и покровительственно оглядывая танцующих.
– Как она мила, к'асавица будет, – сказал Денисов.
– Кто?
– Г'афиня Наташа, – отвечал Денисов.
– И как она танцует, какая г'ация! – помолчав немного, опять сказал он.
– Да про кого ты говоришь?
– Про сест'у п'о твою, – сердито крикнул Денисов.
Ростов усмехнулся.
– Mon cher comte; vous etes l'un de mes meilleurs ecoliers, il faut que vous dansiez, – сказал маленький Иогель, подходя к Николаю. – Voyez combien de jolies demoiselles. [Любезный граф, вы один из лучших моих учеников. Вам надо танцовать. Посмотрите, сколько хорошеньких девушек!] – Он с тою же просьбой обратился и к Денисову, тоже своему бывшему ученику.
– Non, mon cher, je fe'ai tapisse'ie, [Нет, мой милый, я посижу у стенки,] – сказал Денисов. – Разве вы не помните, как дурно я пользовался вашими уроками?
– О нет! – поспешно утешая его, сказал Иогель. – Вы только невнимательны были, а вы имели способности, да, вы имели способности.
Заиграли вновь вводившуюся мазурку; Николай не мог отказать Иогелю и пригласил Соню. Денисов подсел к старушкам и облокотившись на саблю, притопывая такт, что то весело рассказывал и смешил старых дам, поглядывая на танцующую молодежь. Иогель в первой паре танцовал с Наташей, своей гордостью и лучшей ученицей. Мягко, нежно перебирая своими ножками в башмачках, Иогель первым полетел по зале с робевшей, но старательно выделывающей па Наташей. Денисов не спускал с нее глаз и пристукивал саблей такт, с таким видом, который ясно говорил, что он сам не танцует только от того, что не хочет, а не от того, что не может. В середине фигуры он подозвал к себе проходившего мимо Ростова.
– Это совсем не то, – сказал он. – Разве это польская мазу'ка? А отлично танцует. – Зная, что Денисов и в Польше даже славился своим мастерством плясать польскую мазурку, Николай подбежал к Наташе:
– Поди, выбери Денисова. Вот танцует! Чудо! – сказал он.
Когда пришел опять черед Наташе, она встала и быстро перебирая своими с бантиками башмачками, робея, одна пробежала через залу к углу, где сидел Денисов. Она видела, что все смотрят на нее и ждут. Николай видел, что Денисов и Наташа улыбаясь спорили, и что Денисов отказывался, но радостно улыбался. Он подбежал.
– Пожалуйста, Василий Дмитрич, – говорила Наташа, – пойдемте, пожалуйста.
– Да, что, увольте, г'афиня, – говорил Денисов.
– Ну, полно, Вася, – сказал Николай.
– Точно кота Ваську угова'ивают, – шутя сказал Денисов.
– Целый вечер вам буду петь, – сказала Наташа.
– Волшебница всё со мной сделает! – сказал Денисов и отстегнул саблю. Он вышел из за стульев, крепко взял за руку свою даму, приподнял голову и отставил ногу, ожидая такта. Только на коне и в мазурке не видно было маленького роста Денисова, и он представлялся тем самым молодцом, каким он сам себя чувствовал. Выждав такт, он с боку, победоносно и шутливо, взглянул на свою даму, неожиданно пристукнул одной ногой и, как мячик, упруго отскочил от пола и полетел вдоль по кругу, увлекая за собой свою даму. Он не слышно летел половину залы на одной ноге, и, казалось, не видел стоявших перед ним стульев и прямо несся на них; но вдруг, прищелкнув шпорами и расставив ноги, останавливался на каблуках, стоял так секунду, с грохотом шпор стучал на одном месте ногами, быстро вертелся и, левой ногой подщелкивая правую, опять летел по кругу. Наташа угадывала то, что он намерен был сделать, и, сама не зная как, следила за ним – отдаваясь ему. То он кружил ее, то на правой, то на левой руке, то падая на колена, обводил ее вокруг себя, и опять вскакивал и пускался вперед с такой стремительностью, как будто он намерен был, не переводя духа, перебежать через все комнаты; то вдруг опять останавливался и делал опять новое и неожиданное колено. Когда он, бойко закружив даму перед ее местом, щелкнул шпорой, кланяясь перед ней, Наташа даже не присела ему. Она с недоуменьем уставила на него глаза, улыбаясь, как будто не узнавая его. – Что ж это такое? – проговорила она.
Несмотря на то, что Иогель не признавал эту мазурку настоящей, все были восхищены мастерством Денисова, беспрестанно стали выбирать его, и старики, улыбаясь, стали разговаривать про Польшу и про доброе старое время. Денисов, раскрасневшись от мазурки и отираясь платком, подсел к Наташе и весь бал не отходил от нее.
Два дня после этого, Ростов не видал Долохова у своих и не заставал его дома; на третий день он получил от него записку. «Так как я в доме у вас бывать более не намерен по известным тебе причинам и еду в армию, то нынче вечером я даю моим приятелям прощальную пирушку – приезжай в английскую гостинницу». Ростов в 10 м часу, из театра, где он был вместе с своими и Денисовым, приехал в назначенный день в английскую гостинницу. Его тотчас же провели в лучшее помещение гостинницы, занятое на эту ночь Долоховым. Человек двадцать толпилось около стола, перед которым между двумя свечами сидел Долохов. На столе лежало золото и ассигнации, и Долохов метал банк. После предложения и отказа Сони, Николай еще не видался с ним и испытывал замешательство при мысли о том, как они свидятся.
Светлый холодный взгляд Долохова встретил Ростова еще у двери, как будто он давно ждал его.
– Давно не видались, – сказал он, – спасибо, что приехал. Вот только домечу, и явится Илюшка с хором.
– Я к тебе заезжал, – сказал Ростов, краснея.
Долохов не отвечал ему. – Можешь поставить, – сказал он.
Ростов вспомнил в эту минуту странный разговор, который он имел раз с Долоховым. – «Играть на счастие могут только дураки», сказал тогда Долохов.
– Или ты боишься со мной играть? – сказал теперь Долохов, как будто угадав мысль Ростова, и улыбнулся. Из за улыбки его Ростов увидал в нем то настроение духа, которое было у него во время обеда в клубе и вообще в те времена, когда, как бы соскучившись ежедневной жизнью, Долохов чувствовал необходимость каким нибудь странным, большей частью жестоким, поступком выходить из нее.
Ростову стало неловко; он искал и не находил в уме своем шутки, которая ответила бы на слова Долохова. Но прежде, чем он успел это сделать, Долохов, глядя прямо в лицо Ростову, медленно и с расстановкой, так, что все могли слышать, сказал ему:
– А помнишь, мы говорили с тобой про игру… дурак, кто на счастье хочет играть; играть надо наверное, а я хочу попробовать.
«Попробовать на счастие, или наверное?» подумал Ростов.
– Да и лучше не играй, – прибавил он, и треснув разорванной колодой, прибавил: – Банк, господа!
Придвинув вперед деньги, Долохов приготовился метать. Ростов сел подле него и сначала не играл. Долохов взглядывал на него.
– Что ж не играешь? – сказал Долохов. И странно, Николай почувствовал необходимость взять карту, поставить на нее незначительный куш и начать игру.
– Со мной денег нет, – сказал Ростов.
– Поверю!
Ростов поставил 5 рублей на карту и проиграл, поставил еще и опять проиграл. Долохов убил, т. е. выиграл десять карт сряду у Ростова.
– Господа, – сказал он, прометав несколько времени, – прошу класть деньги на карты, а то я могу спутаться в счетах.
Один из игроков сказал, что, он надеется, ему можно поверить.
– Поверить можно, но боюсь спутаться; прошу класть деньги на карты, – отвечал Долохов. – Ты не стесняйся, мы с тобой сочтемся, – прибавил он Ростову.
Игра продолжалась: лакей, не переставая, разносил шампанское.
Все карты Ростова бились, и на него было написано до 800 т рублей. Он надписал было над одной картой 800 т рублей, но в то время, как ему подавали шампанское, он раздумал и написал опять обыкновенный куш, двадцать рублей.
– Оставь, – сказал Долохов, хотя он, казалось, и не смотрел на Ростова, – скорее отыграешься. Другим даю, а тебе бью. Или ты меня боишься? – повторил он.
Ростов повиновался, оставил написанные 800 и поставил семерку червей с оторванным уголком, которую он поднял с земли. Он хорошо ее после помнил. Он поставил семерку червей, надписав над ней отломанным мелком 800, круглыми, прямыми цифрами; выпил поданный стакан согревшегося шампанского, улыбнулся на слова Долохова, и с замиранием сердца ожидая семерки, стал смотреть на руки Долохова, державшего колоду. Выигрыш или проигрыш этой семерки червей означал многое для Ростова. В Воскресенье на прошлой неделе граф Илья Андреич дал своему сыну 2 000 рублей, и он, никогда не любивший говорить о денежных затруднениях, сказал ему, что деньги эти были последние до мая, и что потому он просил сына быть на этот раз поэкономнее. Николай сказал, что ему и это слишком много, и что он дает честное слово не брать больше денег до весны. Теперь из этих денег оставалось 1 200 рублей. Стало быть, семерка червей означала не только проигрыш 1 600 рублей, но и необходимость изменения данному слову. Он с замиранием сердца смотрел на руки Долохова и думал: «Ну, скорей, дай мне эту карту, и я беру фуражку, уезжаю домой ужинать с Денисовым, Наташей и Соней, и уж верно никогда в руках моих не будет карты». В эту минуту домашняя жизнь его, шуточки с Петей, разговоры с Соней, дуэты с Наташей, пикет с отцом и даже спокойная постель в Поварском доме, с такою силою, ясностью и прелестью представились ему, как будто всё это было давно прошедшее, потерянное и неоцененное счастье. Он не мог допустить, чтобы глупая случайность, заставив семерку лечь прежде на право, чем на лево, могла бы лишить его всего этого вновь понятого, вновь освещенного счастья и повергнуть его в пучину еще неиспытанного и неопределенного несчастия. Это не могло быть, но он всё таки ожидал с замиранием движения рук Долохова. Ширококостые, красноватые руки эти с волосами, видневшимися из под рубашки, положили колоду карт, и взялись за подаваемый стакан и трубку.
– Так ты не боишься со мной играть? – повторил Долохов, и, как будто для того, чтобы рассказать веселую историю, он положил карты, опрокинулся на спинку стула и медлительно с улыбкой стал рассказывать:
– Да, господа, мне говорили, что в Москве распущен слух, будто я шулер, поэтому советую вам быть со мной осторожнее.
– Ну, мечи же! – сказал Ростов.
– Ох, московские тетушки! – сказал Долохов и с улыбкой взялся за карты.
– Ааах! – чуть не крикнул Ростов, поднимая обе руки к волосам. Семерка, которая была нужна ему, уже лежала вверху, первой картой в колоде. Он проиграл больше того, что мог заплатить.
– Однако ты не зарывайся, – сказал Долохов, мельком взглянув на Ростова, и продолжая метать.
Через полтора часа времени большинство игроков уже шутя смотрели на свою собственную игру.
Вся игра сосредоточилась на одном Ростове. Вместо тысячи шестисот рублей за ним была записана длинная колонна цифр, которую он считал до десятой тысячи, но которая теперь, как он смутно предполагал, возвысилась уже до пятнадцати тысяч. В сущности запись уже превышала двадцать тысяч рублей. Долохов уже не слушал и не рассказывал историй; он следил за каждым движением рук Ростова и бегло оглядывал изредка свою запись за ним. Он решил продолжать игру до тех пор, пока запись эта не возрастет до сорока трех тысяч. Число это было им выбрано потому, что сорок три составляло сумму сложенных его годов с годами Сони. Ростов, опершись головою на обе руки, сидел перед исписанным, залитым вином, заваленным картами столом. Одно мучительное впечатление не оставляло его: эти ширококостые, красноватые руки с волосами, видневшимися из под рубашки, эти руки, которые он любил и ненавидел, держали его в своей власти.
«Шестьсот рублей, туз, угол, девятка… отыграться невозможно!… И как бы весело было дома… Валет на пе… это не может быть!… И зачем же он это делает со мной?…» думал и вспоминал Ростов. Иногда он ставил большую карту; но Долохов отказывался бить её, и сам назначал куш. Николай покорялся ему, и то молился Богу, как он молился на поле сражения на Амштетенском мосту; то загадывал, что та карта, которая первая попадется ему в руку из кучи изогнутых карт под столом, та спасет его; то рассчитывал, сколько было шнурков на его куртке и с столькими же очками карту пытался ставить на весь проигрыш, то за помощью оглядывался на других играющих, то вглядывался в холодное теперь лицо Долохова, и старался проникнуть, что в нем делалось.
«Ведь он знает, что значит для меня этот проигрыш. Не может же он желать моей погибели? Ведь он друг был мне. Ведь я его любил… Но и он не виноват; что ж ему делать, когда ему везет счастие? И я не виноват, говорил он сам себе. Я ничего не сделал дурного. Разве я убил кого нибудь, оскорбил, пожелал зла? За что же такое ужасное несчастие? И когда оно началось? Еще так недавно я подходил к этому столу с мыслью выиграть сто рублей, купить мама к именинам эту шкатулку и ехать домой. Я так был счастлив, так свободен, весел! И я не понимал тогда, как я был счастлив! Когда же это кончилось, и когда началось это новое, ужасное состояние? Чем ознаменовалась эта перемена? Я всё так же сидел на этом месте, у этого стола, и так же выбирал и выдвигал карты, и смотрел на эти ширококостые, ловкие руки. Когда же это совершилось, и что такое совершилось? Я здоров, силен и всё тот же, и всё на том же месте. Нет, это не может быть! Верно всё это ничем не кончится».
Он был красен, весь в поту, несмотря на то, что в комнате не было жарко. И лицо его было страшно и жалко, особенно по бессильному желанию казаться спокойным.
Запись дошла до рокового числа сорока трех тысяч. Ростов приготовил карту, которая должна была итти углом от трех тысяч рублей, только что данных ему, когда Долохов, стукнув колодой, отложил ее и, взяв мел, начал быстро своим четким, крепким почерком, ломая мелок, подводить итог записи Ростова.
– Ужинать, ужинать пора! Вот и цыгане! – Действительно с своим цыганским акцентом уж входили с холода и говорили что то какие то черные мужчины и женщины. Николай понимал, что всё было кончено; но он равнодушным голосом сказал:
– Что же, не будешь еще? А у меня славная карточка приготовлена. – Как будто более всего его интересовало веселье самой игры.
«Всё кончено, я пропал! думал он. Теперь пуля в лоб – одно остается», и вместе с тем он сказал веселым голосом:
– Ну, еще одну карточку.
– Хорошо, – отвечал Долохов, окончив итог, – хорошо! 21 рубль идет, – сказал он, указывая на цифру 21, рознившую ровный счет 43 тысяч, и взяв колоду, приготовился метать. Ростов покорно отогнул угол и вместо приготовленных 6.000, старательно написал 21.
– Это мне всё равно, – сказал он, – мне только интересно знать, убьешь ты, или дашь мне эту десятку.
Долохов серьезно стал метать. О, как ненавидел Ростов в эту минуту эти руки, красноватые с короткими пальцами и с волосами, видневшимися из под рубашки, имевшие его в своей власти… Десятка была дана.
– За вами 43 тысячи, граф, – сказал Долохов и потягиваясь встал из за стола. – А устаешь однако так долго сидеть, – сказал он.
– Да, и я тоже устал, – сказал Ростов.
Долохов, как будто напоминая ему, что ему неприлично было шутить, перебил его: Когда прикажете получить деньги, граф?
Ростов вспыхнув, вызвал Долохова в другую комнату.
– Я не могу вдруг заплатить всё, ты возьмешь вексель, – сказал он.
– Послушай, Ростов, – сказал Долохов, ясно улыбаясь и глядя в глаза Николаю, – ты знаешь поговорку: «Счастлив в любви, несчастлив в картах». Кузина твоя влюблена в тебя. Я знаю.
«О! это ужасно чувствовать себя так во власти этого человека», – думал Ростов. Ростов понимал, какой удар он нанесет отцу, матери объявлением этого проигрыша; он понимал, какое бы было счастье избавиться от всего этого, и понимал, что Долохов знает, что может избавить его от этого стыда и горя, и теперь хочет еще играть с ним, как кошка с мышью.
– Твоя кузина… – хотел сказать Долохов; но Николай перебил его.
– Моя кузина тут ни при чем, и о ней говорить нечего! – крикнул он с бешенством.
– Так когда получить? – спросил Долохов.
– Завтра, – сказал Ростов, и вышел из комнаты.
Сказать «завтра» и выдержать тон приличия было не трудно; но приехать одному домой, увидать сестер, брата, мать, отца, признаваться и просить денег, на которые не имеешь права после данного честного слова, было ужасно.
Дома еще не спали. Молодежь дома Ростовых, воротившись из театра, поужинав, сидела у клавикорд. Как только Николай вошел в залу, его охватила та любовная, поэтическая атмосфера, которая царствовала в эту зиму в их доме и которая теперь, после предложения Долохова и бала Иогеля, казалось, еще более сгустилась, как воздух перед грозой, над Соней и Наташей. Соня и Наташа в голубых платьях, в которых они были в театре, хорошенькие и знающие это, счастливые, улыбаясь, стояли у клавикорд. Вера с Шиншиным играла в шахматы в гостиной. Старая графиня, ожидая сына и мужа, раскладывала пасьянс с старушкой дворянкой, жившей у них в доме. Денисов с блестящими глазами и взъерошенными волосами сидел, откинув ножку назад, у клавикорд, и хлопая по ним своими коротенькими пальцами, брал аккорды, и закатывая глаза, своим маленьким, хриплым, но верным голосом, пел сочиненное им стихотворение «Волшебница», к которому он пытался найти музыку.
Волшебница, скажи, какая сила
Влечет меня к покинутым струнам;
Какой огонь ты в сердце заронила,
Какой восторг разлился по перстам!
Пел он страстным голосом, блестя на испуганную и счастливую Наташу своими агатовыми, черными глазами.
– Прекрасно! отлично! – кричала Наташа. – Еще другой куплет, – говорила она, не замечая Николая.
«У них всё то же» – подумал Николай, заглядывая в гостиную, где он увидал Веру и мать с старушкой.
– А! вот и Николенька! – Наташа подбежала к нему.
– Папенька дома? – спросил он.
– Как я рада, что ты приехал! – не отвечая, сказала Наташа, – нам так весело. Василий Дмитрич остался для меня еще день, ты знаешь?
– Нет, еще не приезжал папа, – сказала Соня.
– Коко, ты приехал, поди ко мне, дружок! – сказал голос графини из гостиной. Николай подошел к матери, поцеловал ее руку и, молча подсев к ее столу, стал смотреть на ее руки, раскладывавшие карты. Из залы всё слышались смех и веселые голоса, уговаривавшие Наташу.
– Ну, хорошо, хорошо, – закричал Денисов, – теперь нечего отговариваться, за вами barcarolla, умоляю вас.
Графиня оглянулась на молчаливого сына.
– Что с тобой? – спросила мать у Николая.
– Ах, ничего, – сказал он, как будто ему уже надоел этот всё один и тот же вопрос.
– Папенька скоро приедет?
– Я думаю.
«У них всё то же. Они ничего не знают! Куда мне деваться?», подумал Николай и пошел опять в залу, где стояли клавикорды.
Соня сидела за клавикордами и играла прелюдию той баркароллы, которую особенно любил Денисов. Наташа собиралась петь. Денисов восторженными глазами смотрел на нее.
Николай стал ходить взад и вперед по комнате.
«И вот охота заставлять ее петь? – что она может петь? И ничего тут нет веселого», думал Николай.
Соня взяла первый аккорд прелюдии.
«Боже мой, я погибший, я бесчестный человек. Пулю в лоб, одно, что остается, а не петь, подумал он. Уйти? но куда же? всё равно, пускай поют!»
Николай мрачно, продолжая ходить по комнате, взглядывал на Денисова и девочек, избегая их взглядов.
«Николенька, что с вами?» – спросил взгляд Сони, устремленный на него. Она тотчас увидала, что что нибудь случилось с ним.
Николай отвернулся от нее. Наташа с своею чуткостью тоже мгновенно заметила состояние своего брата. Она заметила его, но ей самой так было весело в ту минуту, так далека она была от горя, грусти, упреков, что она (как это часто бывает с молодыми людьми) нарочно обманула себя. Нет, мне слишком весело теперь, чтобы портить свое веселье сочувствием чужому горю, почувствовала она, и сказала себе:
«Нет, я верно ошибаюсь, он должен быть весел так же, как и я». Ну, Соня, – сказала она и вышла на самую середину залы, где по ее мнению лучше всего был резонанс. Приподняв голову, опустив безжизненно повисшие руки, как это делают танцовщицы, Наташа, энергическим движением переступая с каблучка на цыпочку, прошлась по середине комнаты и остановилась.
«Вот она я!» как будто говорила она, отвечая на восторженный взгляд Денисова, следившего за ней.
«И чему она радуется! – подумал Николай, глядя на сестру. И как ей не скучно и не совестно!» Наташа взяла первую ноту, горло ее расширилось, грудь выпрямилась, глаза приняли серьезное выражение. Она не думала ни о ком, ни о чем в эту минуту, и из в улыбку сложенного рта полились звуки, те звуки, которые может производить в те же промежутки времени и в те же интервалы всякий, но которые тысячу раз оставляют вас холодным, в тысячу первый раз заставляют вас содрогаться и плакать.
Наташа в эту зиму в первый раз начала серьезно петь и в особенности оттого, что Денисов восторгался ее пением. Она пела теперь не по детски, уж не было в ее пеньи этой комической, ребяческой старательности, которая была в ней прежде; но она пела еще не хорошо, как говорили все знатоки судьи, которые ее слушали. «Не обработан, но прекрасный голос, надо обработать», говорили все. Но говорили это обыкновенно уже гораздо после того, как замолкал ее голос. В то же время, когда звучал этот необработанный голос с неправильными придыханиями и с усилиями переходов, даже знатоки судьи ничего не говорили, и только наслаждались этим необработанным голосом и только желали еще раз услыхать его. В голосе ее была та девственная нетронутость, то незнание своих сил и та необработанная еще бархатность, которые так соединялись с недостатками искусства пенья, что, казалось, нельзя было ничего изменить в этом голосе, не испортив его.
«Что ж это такое? – подумал Николай, услыхав ее голос и широко раскрывая глаза. – Что с ней сделалось? Как она поет нынче?» – подумал он. И вдруг весь мир для него сосредоточился в ожидании следующей ноты, следующей фразы, и всё в мире сделалось разделенным на три темпа: «Oh mio crudele affetto… [О моя жестокая любовь…] Раз, два, три… раз, два… три… раз… Oh mio crudele affetto… Раз, два, три… раз. Эх, жизнь наша дурацкая! – думал Николай. Всё это, и несчастье, и деньги, и Долохов, и злоба, и честь – всё это вздор… а вот оно настоящее… Hy, Наташа, ну, голубчик! ну матушка!… как она этот si возьмет? взяла! слава Богу!» – и он, сам не замечая того, что он поет, чтобы усилить этот si, взял втору в терцию высокой ноты. «Боже мой! как хорошо! Неужели это я взял? как счастливо!» подумал он.
О! как задрожала эта терция, и как тронулось что то лучшее, что было в душе Ростова. И это что то было независимо от всего в мире, и выше всего в мире. Какие тут проигрыши, и Долоховы, и честное слово!… Всё вздор! Можно зарезать, украсть и всё таки быть счастливым…
Давно уже Ростов не испытывал такого наслаждения от музыки, как в этот день. Но как только Наташа кончила свою баркароллу, действительность опять вспомнилась ему. Он, ничего не сказав, вышел и пошел вниз в свою комнату. Через четверть часа старый граф, веселый и довольный, приехал из клуба. Николай, услыхав его приезд, пошел к нему.
– Ну что, повеселился? – сказал Илья Андреич, радостно и гордо улыбаясь на своего сына. Николай хотел сказать, что «да», но не мог: он чуть было не зарыдал. Граф раскуривал трубку и не заметил состояния сына.
«Эх, неизбежно!» – подумал Николай в первый и последний раз. И вдруг самым небрежным тоном, таким, что он сам себе гадок казался, как будто он просил экипажа съездить в город, он сказал отцу.
– Папа, а я к вам за делом пришел. Я было и забыл. Мне денег нужно.
– Вот как, – сказал отец, находившийся в особенно веселом духе. – Я тебе говорил, что не достанет. Много ли?
– Очень много, – краснея и с глупой, небрежной улыбкой, которую он долго потом не мог себе простить, сказал Николай. – Я немного проиграл, т. е. много даже, очень много, 43 тысячи.
– Что? Кому?… Шутишь! – крикнул граф, вдруг апоплексически краснея шеей и затылком, как краснеют старые люди.
– Я обещал заплатить завтра, – сказал Николай.
– Ну!… – сказал старый граф, разводя руками и бессильно опустился на диван.
– Что же делать! С кем это не случалось! – сказал сын развязным, смелым тоном, тогда как в душе своей он считал себя негодяем, подлецом, который целой жизнью не мог искупить своего преступления. Ему хотелось бы целовать руки своего отца, на коленях просить его прощения, а он небрежным и даже грубым тоном говорил, что это со всяким случается.
Граф Илья Андреич опустил глаза, услыхав эти слова сына и заторопился, отыскивая что то.
– Да, да, – проговорил он, – трудно, я боюсь, трудно достать…с кем не бывало! да, с кем не бывало… – И граф мельком взглянул в лицо сыну и пошел вон из комнаты… Николай готовился на отпор, но никак не ожидал этого.
– Папенька! па…пенька! – закричал он ему вслед, рыдая; простите меня! – И, схватив руку отца, он прижался к ней губами и заплакал.
В то время, как отец объяснялся с сыном, у матери с дочерью происходило не менее важное объяснение. Наташа взволнованная прибежала к матери.
– Мама!… Мама!… он мне сделал…
– Что сделал?
– Сделал, сделал предложение. Мама! Мама! – кричала она. Графиня не верила своим ушам. Денисов сделал предложение. Кому? Этой крошечной девочке Наташе, которая еще недавно играла в куклы и теперь еще брала уроки.
– Наташа, полно, глупости! – сказала она, еще надеясь, что это была шутка.
– Ну вот, глупости! – Я вам дело говорю, – сердито сказала Наташа. – Я пришла спросить, что делать, а вы мне говорите: «глупости»…
Графиня пожала плечами.
– Ежели правда, что мосьё Денисов сделал тебе предложение, то скажи ему, что он дурак, вот и всё.
– Нет, он не дурак, – обиженно и серьезно сказала Наташа.
– Ну так что ж ты хочешь? Вы нынче ведь все влюблены. Ну, влюблена, так выходи за него замуж! – сердито смеясь, проговорила графиня. – С Богом!
– Нет, мама, я не влюблена в него, должно быть не влюблена в него.
– Ну, так так и скажи ему.
– Мама, вы сердитесь? Вы не сердитесь, голубушка, ну в чем же я виновата?
– Нет, да что же, мой друг? Хочешь, я пойду скажу ему, – сказала графиня, улыбаясь.
– Нет, я сама, только научите. Вам всё легко, – прибавила она, отвечая на ее улыбку. – А коли бы видели вы, как он мне это сказал! Ведь я знаю, что он не хотел этого сказать, да уж нечаянно сказал.
– Ну всё таки надо отказать.
– Нет, не надо. Мне так его жалко! Он такой милый.
– Ну, так прими предложение. И то пора замуж итти, – сердито и насмешливо сказала мать.
– Нет, мама, мне так жалко его. Я не знаю, как я скажу.
– Да тебе и нечего говорить, я сама скажу, – сказала графиня, возмущенная тем, что осмелились смотреть, как на большую, на эту маленькую Наташу.
– Нет, ни за что, я сама, а вы слушайте у двери, – и Наташа побежала через гостиную в залу, где на том же стуле, у клавикорд, закрыв лицо руками, сидел Денисов. Он вскочил на звук ее легких шагов.
– Натали, – сказал он, быстрыми шагами подходя к ней, – решайте мою судьбу. Она в ваших руках!
– Василий Дмитрич, мне вас так жалко!… Нет, но вы такой славный… но не надо… это… а так я вас всегда буду любить.
Денисов нагнулся над ее рукою, и она услыхала странные, непонятные для нее звуки. Она поцеловала его в черную, спутанную, курчавую голову. В это время послышался поспешный шум платья графини. Она подошла к ним.
– Василий Дмитрич, я благодарю вас за честь, – сказала графиня смущенным голосом, но который казался строгим Денисову, – но моя дочь так молода, и я думала, что вы, как друг моего сына, обратитесь прежде ко мне. В таком случае вы не поставили бы меня в необходимость отказа.
– Г'афиня, – сказал Денисов с опущенными глазами и виноватым видом, хотел сказать что то еще и запнулся.
Наташа не могла спокойно видеть его таким жалким. Она начала громко всхлипывать.
– Г'афиня, я виноват перед вами, – продолжал Денисов прерывающимся голосом, – но знайте, что я так боготво'ю вашу дочь и всё ваше семейство, что две жизни отдам… – Он посмотрел на графиню и, заметив ее строгое лицо… – Ну п'ощайте, г'афиня, – сказал он, поцеловал ее руку и, не взглянув на Наташу, быстрыми, решительными шагами вышел из комнаты.
На другой день Ростов проводил Денисова, который не хотел более ни одного дня оставаться в Москве. Денисова провожали у цыган все его московские приятели, и он не помнил, как его уложили в сани и как везли первые три станции.
После отъезда Денисова, Ростов, дожидаясь денег, которые не вдруг мог собрать старый граф, провел еще две недели в Москве, не выезжая из дому, и преимущественно в комнате барышень.
Соня была к нему нежнее и преданнее чем прежде. Она, казалось, хотела показать ему, что его проигрыш был подвиг, за который она теперь еще больше любит его; но Николай теперь считал себя недостойным ее.
Он исписал альбомы девочек стихами и нотами, и не простившись ни с кем из своих знакомых, отослав наконец все 43 тысячи и получив росписку Долохова, уехал в конце ноября догонять полк, который уже был в Польше.
После своего объяснения с женой, Пьер поехал в Петербург. В Торжке на cтанции не было лошадей, или не хотел их смотритель. Пьер должен был ждать. Он не раздеваясь лег на кожаный диван перед круглым столом, положил на этот стол свои большие ноги в теплых сапогах и задумался.
– Прикажете чемоданы внести? Постель постелить, чаю прикажете? – спрашивал камердинер.
Пьер не отвечал, потому что ничего не слыхал и не видел. Он задумался еще на прошлой станции и всё продолжал думать о том же – о столь важном, что он не обращал никакого .внимания на то, что происходило вокруг него. Его не только не интересовало то, что он позже или раньше приедет в Петербург, или то, что будет или не будет ему места отдохнуть на этой станции, но всё равно было в сравнении с теми мыслями, которые его занимали теперь, пробудет ли он несколько часов или всю жизнь на этой станции.
Смотритель, смотрительша, камердинер, баба с торжковским шитьем заходили в комнату, предлагая свои услуги. Пьер, не переменяя своего положения задранных ног, смотрел на них через очки, и не понимал, что им может быть нужно и каким образом все они могли жить, не разрешив тех вопросов, которые занимали его. А его занимали всё одни и те же вопросы с самого того дня, как он после дуэли вернулся из Сокольников и провел первую, мучительную, бессонную ночь; только теперь в уединении путешествия, они с особенной силой овладели им. О чем бы он ни начинал думать, он возвращался к одним и тем же вопросам, которых он не мог разрешить, и не мог перестать задавать себе. Как будто в голове его свернулся тот главный винт, на котором держалась вся его жизнь. Винт не входил дальше, не выходил вон, а вертелся, ничего не захватывая, всё на том же нарезе, и нельзя было перестать вертеть его.
Вошел смотритель и униженно стал просить его сиятельство подождать только два часика, после которых он для его сиятельства (что будет, то будет) даст курьерских. Смотритель очевидно врал и хотел только получить с проезжего лишние деньги. «Дурно ли это было или хорошо?», спрашивал себя Пьер. «Для меня хорошо, для другого проезжающего дурно, а для него самого неизбежно, потому что ему есть нечего: он говорил, что его прибил за это офицер. А офицер прибил за то, что ему ехать надо было скорее. А я стрелял в Долохова за то, что я счел себя оскорбленным, а Людовика XVI казнили за то, что его считали преступником, а через год убили тех, кто его казнил, тоже за что то. Что дурно? Что хорошо? Что надо любить, что ненавидеть? Для чего жить, и что такое я? Что такое жизнь, что смерть? Какая сила управляет всем?», спрашивал он себя. И не было ответа ни на один из этих вопросов, кроме одного, не логического ответа, вовсе не на эти вопросы. Ответ этот был: «умрешь – всё кончится. Умрешь и всё узнаешь, или перестанешь спрашивать». Но и умереть было страшно.
Торжковская торговка визгливым голосом предлагала свой товар и в особенности козловые туфли. «У меня сотни рублей, которых мне некуда деть, а она в прорванной шубе стоит и робко смотрит на меня, – думал Пьер. И зачем нужны эти деньги? Точно на один волос могут прибавить ей счастья, спокойствия души, эти деньги? Разве может что нибудь в мире сделать ее и меня менее подверженными злу и смерти? Смерть, которая всё кончит и которая должна притти нынче или завтра – всё равно через мгновение, в сравнении с вечностью». И он опять нажимал на ничего не захватывающий винт, и винт всё так же вертелся на одном и том же месте.
Слуга его подал ему разрезанную до половины книгу романа в письмах m mе Suza. [мадам Сюза.] Он стал читать о страданиях и добродетельной борьбе какой то Аmelie de Mansfeld. [Амалии Мансфельд.] «И зачем она боролась против своего соблазнителя, думал он, – когда она любила его? Не мог Бог вложить в ее душу стремления, противного Его воле. Моя бывшая жена не боролась и, может быть, она была права. Ничего не найдено, опять говорил себе Пьер, ничего не придумано. Знать мы можем только то, что ничего не знаем. И это высшая степень человеческой премудрости».
Всё в нем самом и вокруг него представлялось ему запутанным, бессмысленным и отвратительным. Но в этом самом отвращении ко всему окружающему Пьер находил своего рода раздражающее наслаждение.
– Осмелюсь просить ваше сиятельство потесниться крошечку, вот для них, – сказал смотритель, входя в комнату и вводя за собой другого, остановленного за недостатком лошадей проезжающего. Проезжающий был приземистый, ширококостый, желтый, морщинистый старик с седыми нависшими бровями над блестящими, неопределенного сероватого цвета, глазами.
Пьер снял ноги со стола, встал и перелег на приготовленную для него кровать, изредка поглядывая на вошедшего, который с угрюмо усталым видом, не глядя на Пьера, тяжело раздевался с помощью слуги. Оставшись в заношенном крытом нанкой тулупчике и в валеных сапогах на худых костлявых ногах, проезжий сел на диван, прислонив к спинке свою очень большую и широкую в висках, коротко обстриженную голову и взглянул на Безухого. Строгое, умное и проницательное выражение этого взгляда поразило Пьера. Ему захотелось заговорить с проезжающим, но когда он собрался обратиться к нему с вопросом о дороге, проезжающий уже закрыл глаза и сложив сморщенные старые руки, на пальце одной из которых был большой чугунный перстень с изображением Адамовой головы, неподвижно сидел, или отдыхая, или о чем то глубокомысленно и спокойно размышляя, как показалось Пьеру. Слуга проезжающего был весь покрытый морщинами, тоже желтый старичек, без усов и бороды, которые видимо не были сбриты, а никогда и не росли у него. Поворотливый старичек слуга разбирал погребец, приготовлял чайный стол, и принес кипящий самовар. Когда всё было готово, проезжающий открыл глаза, придвинулся к столу и налив себе один стакан чаю, налил другой безбородому старичку и подал ему. Пьер начинал чувствовать беспокойство и необходимость, и даже неизбежность вступления в разговор с этим проезжающим.
Слуга принес назад свой пустой, перевернутый стакан с недокусанным кусочком сахара и спросил, не нужно ли чего.
– Ничего. Подай книгу, – сказал проезжающий. Слуга подал книгу, которая показалась Пьеру духовною, и проезжающий углубился в чтение. Пьер смотрел на него. Вдруг проезжающий отложил книгу, заложив закрыл ее и, опять закрыв глаза и облокотившись на спинку, сел в свое прежнее положение. Пьер смотрел на него и не успел отвернуться, как старик открыл глаза и уставил свой твердый и строгий взгляд прямо в лицо Пьеру.
Пьер чувствовал себя смущенным и хотел отклониться от этого взгляда, но блестящие, старческие глаза неотразимо притягивали его к себе.
– Имею удовольствие говорить с графом Безухим, ежели я не ошибаюсь, – сказал проезжающий неторопливо и громко. Пьер молча, вопросительно смотрел через очки на своего собеседника.
